Природа и свойства ковалентной связи на примере строения молекул (H2, HCl, H2O).
Образование ковалентной неполярной связи.
H+H 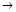 H2
H2
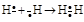
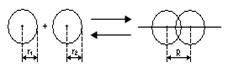
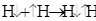
+ Q
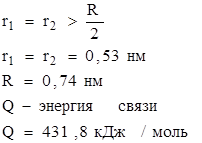
Ковалентная связь бывает полярной и неполярной. Ковалентная неполярная связь образуется между двумя одинаковыми атомами (  ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи  и ковалентные связи
и ковалентные связи  .
.
Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
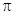 связь – образуется при таком перекрывании
связь – образуется при таком перекрывании 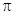 атомных орбиталей, когда область максимальной электронной области находится над и под плоскостью, в которой лежит прямая соединяющая центры атомов.
атомных орбиталей, когда область максимальной электронной области находится над и под плоскостью, в которой лежит прямая соединяющая центры атомов.
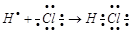
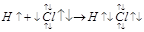
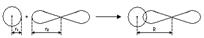 + Q
+ Q
H2O
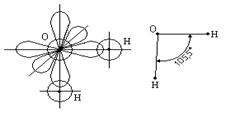
Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды.
Свойства ковалентной связи:
1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи.
2. Ковалентная связь бывает полярной и неполярной:
а) Ковалентная неполярная связь образуется между двумя одинаковыми атомами (  ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
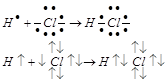
При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи.
Электроотрицательность – это условие вещества, характеризующее свойство данного атома притягивать к себе общую электронную пару при образовании химической связи. Электроотрицательность атомов в ПСХЭ с возрастом порядкового номера в периоде возрастает, в группе уменьшается (F – самый электроотрицательный атом).
В молекулах с полярной ковалентной связью электрические заряды распределены неравномерно и за счет смещения общей электронной пары в сторону электроотрицательности атома на нем появляются избыток отрицательных зарядов, в то время как на другом атоме недостаток. Такие молекулы с неравным распределением зарядов называется диполями. Молекулы с ковалентной полярной связью являются диполями. Такие молекулы надо характеризовать дипольным моментом 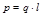 , q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.
, q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.
3. Ковалентные связи поляризуются. Дипольные моменты поляризованных молекул увеличивается во внешних электрических полях, а также если они попадают в окружение других полярных молекул. Поляризация таких моментов может происходить вплоть до ионизации.
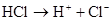
4. Ковалентные связи направлены, т.к. атомные орбитали за счет которых они образуются, определенным образом ориентированы в пространстве. Максимум перекрывания атомных орбиталей обеспечивается при их определенной взаимной ориентации. При этом атомные орбитали, находящиеся в общем владении двух атомов, будут находится под определенным углом друг к другу. Этот угол называется валентным.
5. Ковалентная связь насыщена, каждый из не спаренных электронов атома при ее образовании спаривается, поэтому ковалентная связь может быть кратной.
Дата добавления: 2015-08-08; просмотров: 4127;
