Принцип Паули.
Принцип Паули говорит, что в атоме не может быть двух электронов, имеющих одинаковый набор 4-х квантовых чисел.
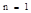
| 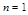
|
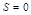
| 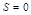
|
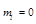
| 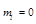
|

| 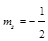
|
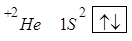
Значит, на одной АО могут находиться два электрона различных по значению спинового квантового числа.
| 3. Правило Хунда: если в атоме имеется несколько орбиталей одного подуровня, то состоянию с меньшей энергией будет соответствовать использование большего числа орбиталей. |
| 2P2 | 
| 
| ||||
| 2S2 | 
| |||||
| 1S2 | 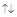
| |||||
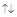
| ||||||
| 4. Правило Клечковского: 1) при увеличении заряда ядра атома последовательное заполнение атомных орбиталей происходит от орбиталей с меньшим значением n+l к орбиталям с большим значением n+l; 2) при одинаковой значениях суммы n+l заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа. |
Периодические изменения свойств элементов в связи с электронной структурой их атомов.
Периодическая система элементов Д. И. Менделеева как естественная классификация элементов по электронной структуре их атомов.
Периодические изменения свойств химических элементов обнаруженные Д. И. Менделеевым можно объяснить, рассматривая электронную структуру атомов.
Положение химического элемента в периодической системе соответствует электронному строению его атома, при этом в одной группе оказываются элементы, имеющие одинаковое число электронов на внешнем энергетическом уровне. Всякие элементы в периодической системе находятся на пересечении горизонтального и вертикального ряда. Номер группы соответствует числу электронов на внешнем энергетическом уровне атома, а номер периода совпадает с числом энергетических уровней в атоме и указывает номер внешнего энергетического уровня.
Период – это горизонтальный ряд электронов, расположенных по возрастанию атомной массы, заряда ядра, числа электронов в атоме, начинающийся с типичного металла и заканчивающийся инертным газом  свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с ростом порядкового номера потенциал ионизации атомов в периоде увеличивается, в группе – уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат только S-электроны, называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы, 3-группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут, как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов).
Большинство элементов в ПСХЭ металлы, в то же время металлы, могут применять свойства в широком диапазоне, т.к. это элементы, имеющие различное строение предвнешних энергетических уровней, т.е. металлы s, d – семейства, позволяющие иметь большое многообразие веществ и материи на их основе, обладающих различными свойствами в зависимости от условий, в которых они находятся. В целом любой элемент ПСХЭ уникален, т.к. имеет свою собственную электронную конфигурацию. Свои собственные возможности стабилизации энергетических состояний или за счет перехода электронов на вакантные атомные орбитали (d и f – элементы), или за счет взаимодействия с другими атомами с отдачей электронов или их принятием.
Периодическое изменение свойств химических элементов объясняется периодическим повторением электронной конфигурации внешних энергетических уровней.
Энергия ионизации, сродство к электрону и Электроотрицательность.
Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с увеличением порядкового номера потенциалы ионизации атомов возрастают, т. е. способность атомов отдавать электроны уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат, только S-электроны называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы 3 группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов).
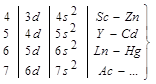 Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они:
Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они:
1)Могут обладать переменной валентностью;
2)Обладают специфическими физическими свойствами (например, электропроводность) за счёт вакантных d-орбиталей.
В 6 периоде от La – Lu и в 7 от Ac – Lr формируются подуровни f:
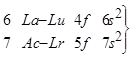 La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства.
La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства.
Один и тот же атом может принимать электроны, проявляя к ним сродство, или отдавать электроны другому атому, у которого сродство к электрону больше.
Электроотрицательность позволяет оценить возможность взаимодействия между данными атомами и прогнозировать распределение зарядов электронных облаков в образующемся соединении.
Электроотрицательность представляет собой периодическую функцию, величина которой позволяет оценивать поведение атома данного элемента при химических реакциях, а также влияние этого атома на распределение электронной плотности в уже готовых молекулах.
Энергия ионизации — энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в основном энергетическом состоянии; обычно выражается в электрон-вольтах. Многоэлектронные атомы имеют несколько значений энергии ионизации:
I1, I2 ..., соответствующих отрыву первого, второго и т. д. электронов, при этом всегда 71</2</3<... .
Энергия ионизации периодически изменяется. Для элементов каждого периода она возрастает слева направо с увеличением заряда ядра; в главных подгруппах уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра, а в побочных подгруппах наблюдается более сложная закономерность (сначала уменьшается, а затем растет).
Дата добавления: 2015-08-08; просмотров: 910;
