Квантовые числа.
Состояние электрона в квантовой системе определяется четырьмя квантовыми числами: n, l, 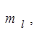
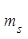 . Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа.
. Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа.
1. Главное квантовое число (ввел Бор) 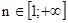 .
.
Физический смысл: задает размер атомной орбитали и определяет энергетический уровень электрона в атоме.
2. Орбитальное квантовое число, 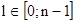 .
.
Физический смысл: определяет форму атомной орбитали, энергетический уровень.
Атомная орбиталь (АО) – это область околоядерного пространства, для которой вероятность нахождения электрона составляет 95%. Каждый электрон в атоме занимает соответствующую АО, т.е. область определенного размера (n), определенной формы (l) и определенной ориентации в магнитном поле земли. АО могут быть одинакового размера, но разной формы, следовательно, размер задаст энергетический уровень, а форма – энергетический подуровень.
Численным значениям орбитального квантового числа в квантовой механике даня соответствующие буквенные значения:
Пример: n=2
l = 0 (s-орбиталь) или l = 1(p-орбиталь)
l = 2(d-орбиталь) l = 3 (f-орбиталь)
3. Магнитное квантовое число 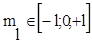 Общее число значений магнитного квантового числа равно:
Общее число значений магнитного квантового числа равно: 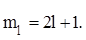
Физический смысл: определяет пространственную ориентацию в магнитном поле. В общем случае число атомных орбиталей определяется суммой значений магнитного квантового числа.
4.Спиновое квантовое число, принимает значение 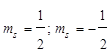 . Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению
. Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению 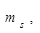 такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле:
такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле: 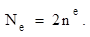
Дата добавления: 2015-08-08; просмотров: 1202;
