Строение атома.
Сложность строения атома в конце XIX века стала очевидной в результате множеству научных открытий.
Работы Фарадея, показали, что превращение веществ возможны под действием постоянного электрического тока. Откуда следует, что в состав атома входят заряженные частицы, притом, как атом в целом нейтральный. Открытие периодического закона Менделеевым, показало что атомы состоят из единообразных структурных единиц, накопление которых приводит к изменению свойств атомов и эти свойства периодически повторяются, следовательно определяют пространственную организацию структурных единиц атома. Свойство простых веществ ( атомов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомных масс. Если увеличится атомная масса, то свойства атома изменятся. Это открытие стимулировало процесс изучения структуры атома.
В 1895 году английский ученый Фрупс, изучая электрические разряды в газовых турбинах при пониженном давлении, обнаружил катодные лучи, которые представляют собой поток светящихся заряженных частиц.
В 1897 году Томсон определил отношения заряда частиц к их массе и определил, что это величена постоянная для многих зарядов, значит, эти частицы входят в состав всех атомов. Он определил, что это отрицательно заряженные частицы и назвал их электронами.
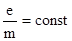
Мелеккен определил заряд частиц и их массу:
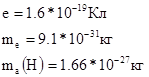
«Атом состоит из положительно заряженной сферы, в которую вкраплены электроны, число электронов определяется положительным зарядом сферы». (Томсон)
Одновременно было открыто явление естественной радиоактивности, т. е. самопроизвольный распад атомов тяжелых элементов с превращением их в атомы элементов с меньшей массой и выбросом излучения в виде потоков электронов ( 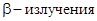 ) и потоков
) и потоков 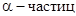 (
( 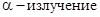 ).
).
Позднее было показано, что можно вызвать деление ядер любого атома, если оказать на него определенное физическое воздействие (в частности путем бомбардировки атомов ускоренными 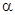 - частицами).
- частицами).
Резерфорд в1913 году бомбардировал тонкие металлические пластинки ускоренными 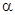 - частицами и, обнаружил их рассеяние, на основании чего предложил ядерную модель атома. Атом состоит из ядра, т.е. очень малый объем атома, в котором, сосредоточена основная масса атома несущая положительный заряд, в около ядерном пространстве по круговым орбитам вращаются электроны. Опыты Резерфорда были использованы для определения величины заряда атомных ядер. При этом он установил, что заряд ядра атома совпадает с порядковым номером элемента в ПСХЭ.
- частицами и, обнаружил их рассеяние, на основании чего предложил ядерную модель атома. Атом состоит из ядра, т.е. очень малый объем атома, в котором, сосредоточена основная масса атома несущая положительный заряд, в около ядерном пространстве по круговым орбитам вращаются электроны. Опыты Резерфорда были использованы для определения величины заряда атомных ядер. При этом он установил, что заряд ядра атома совпадает с порядковым номером элемента в ПСХЭ.
В 1913 году Мозли измеряя длины волн, излучаемые различными металлами, из которых изготовлен катод рентгеновской трубки, установил функциональную зависимость. После открытия Мозли была изменена форма ПС.
Свойства простых веществ, а также форма и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер.
Модель атома вещества по Бору.
Нильс Бор изучая спектры поглощения и испускания атомов водорода обнаружил, что они имеют линейчатый характер, что атомы излучают энергию дискретно, т.е. определенными порциями, в то время как по Резерфорду электрон двигаясь вокруг ядра должен изменять свою энергию непрерывно и, в конечном счете упасть на ядро, но оказалось, что реальные атомы устойчивы и излучают энергию дискретно, на основании чего не отвергая модели Резерфорда, приписал ей два постулата несвойственных по классическим представлениям свойств.
Свою теорию Бор изложил в виде двух постулатов:
1. Электрон, двигаясь вокруг ядра, энергии не излучает.
2. Электрон может вращаться вокруг ядра только по некоторым круговым орбиталям, удовлетворяющим отношению (1). Эти орбитали называются стационарными.
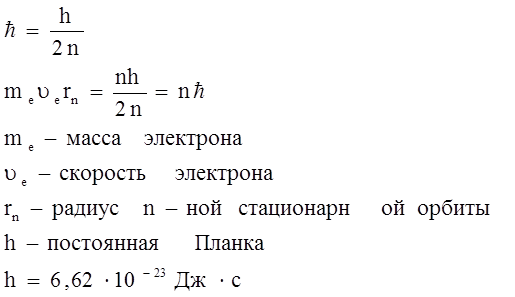
n – число натурального ряда (1;+ 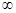 ) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме.
) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме.
Учитывая, что 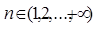 для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
3. Любое испускание или поглощение энергии атомов происходит при переходе атома из одного стационарного состояния в другое. При переходе атома из стационарного состояния с энергией En в состояние с энергией Em излучается или поглощается квант, частота которого определяется уравнением:
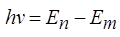
h – постоянная Планка
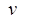 – частота электромагнитного излучения поглощённого или излучённого атомом.
– частота электромагнитного излучения поглощённого или излучённого атомом.
Модель Бора в противоречие моделей Резерфорда не снимало квантование энергии атомов, физически не объясняла, а искусственно постулировала - стала фундаментальной для квантовой механики.
Дата добавления: 2015-08-08; просмотров: 727;
