Масса эквивалента соли
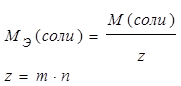
m – число атомов металла в соли
n – валентность

Массы реагирующих веществ относятся как молярные массы их эквивалентов.
Для газообразных веществ используют понятия эквивалентные объемы – это объем занимаемый 1 моль эквивалента вещества.
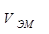 - это объём 1 моль эквивалента вещества
- это объём 1 моль эквивалента вещества

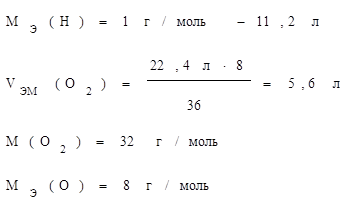
Закон Авогадро.
Это один из законов естествознания: в равных объёмах любых газов при одинаковых физических условиях содержится одинаковое число частиц (молекул или атомов, если простое вещество, как, например, He, Ar).
Этот закон применим также и для ионов и электронов ионизованных газов в том числе, если их концентрация не очень велика и воздействием внешних электрических и магнитных полей можно пренебречь.
Позднее (в середине 1850-х годов) Жераром получены следствия из закона Авогадро, на основании которых он предложил метод определения молекулярных масс независимо от химического состава молекул газообразных веществ.
Первое следствие: грамм-молекулы любых газов имеют равный объем при одинаковых физических условиях. Молярный объем газа при нормальных условиях (0°С, 760 мм рт. ст.):
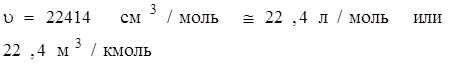
Второе следствие: молекулярная масса газообразного вещества равна удвоенной плотности его по водороду (точнее 2,016 плотности). Это следствие из закона Авогадро выводится очень легко. Пусть мы имеем два одинаковых объема разных газов при одинаковых физических условиях. Массы их в данных объемах будут разными:

Дата добавления: 2015-08-08; просмотров: 1580;
