Законы Рауля.
1.Тонаскапический закон: понижение давления (∆p) насыщенного пара над раствором по сравнению с чистым растворителем прямопропорционален числу моль растворенного вещества и обратно пропорционален количеству растворителя.

p0 – давление насыщенного пара над растворителем (например вода), p - давление насыщенного пара над раствором, n – количество растворенного вещества, N – количество растворителя.
2. Эбулиоскапический – повышение температуры кипения раствора по сравнению с чистым растворителем (∆T) прямопропорционально молярной концентрации раствора.
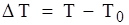 ; T0 – температура кипения чистого растворителя; T – температура кипения раствора.
; T0 – температура кипения чистого растворителя; T – температура кипения раствора.
∆Tкип=Kэб Сm ; Kэб=const – эбулеотостатическая константа (справочная величина характерная для растворителя).
3. Криоскопический (крио-холод) – изменение температуры замерзания раствора по сравнению с чистым растворителем пропорционален молярной концентрации.
∆Tзам=Kкр Сm 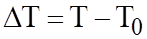 T0 – температура замерзания растворителя, T – температура замерзания раствора.
T0 – температура замерзания растворителя, T – температура замерзания раствора.
Kкр=const – криоскопическая константа (справочная величина).
Изменение температуры замерзания в смеси веществ тепловые эффекты при смешивании веществ используются в технике для приготовления систем охлаждающих жидкости.
Эти законы соблюдаются для растворов, где между молекулами растворителя распределены молекулы растворенного вещества (молекулярный раствор) и они не соблюдаются для растворов кислот, щелочей и солей.
Дата добавления: 2015-08-08; просмотров: 729;
