Сильные электролиты.
К сильным электролитам относится: минеральные кислоты (серная, соляная, азотная, фосфорная), гидроксиды щелочных и щелочноземельных металлов, металлы I, II группы ПСХЭ (водные растворы таких гидросксидов называются щелочами), большинство солей (имеют ионный тип связи и в узлах кристаллической решетки находятся ионы). Молекулы воды являются диполями (окружающиеся ионы ориентируясь отрицательным полюсом к катиону и положительным к аниону) тем самым разрушая ионную связь. Степень диссоциации таких соединений теоретически должна быть равна 100%, но концентрация ионов, которую можно обнаружить в растворе практическим путем (путем определения электропроводимости раствора) оказывается всегда меньшей, чем теоретически ожидаемая. Поэтому сильные электролиты принято характеризовать величиной (a) активной концентрации (активность).
Активная концентрация ионов – это концентрация ионов в растворе, которая фактически проявляется в определенной величине электропроводности раствора и в целом в химических взаимодействиях иона. Понижение активности по сравнению с заданной концентрации связано с тем, что ионы в растворе окружены противоионами, молекулами растворителя и при своем движении несут с собой так называемую ионную атмосферу. В связи с этим приготовив раствор определенной концентрации данного электролита, необходимо и возможно рассчитать активность металлов a=f·С, где f – коэффициент активности ионов, он зависит от природы растворителя и от концентрации раствора, то что активность иона всегда ниже их концентрации объясняется тем, что ион в растворе взаимодействует с другими ионами, с молекулами воды, окружающей ионной атмосферой, которая снижает его реакционную способность. Зависит от с f=f(С), как правило, f возрастает при снижении С, f=const, С – концентрация ионов в растворе
С(KCl)=1моль/л, С(K+)=1моль/л, С(Cl–)=1моль/л.
Кислоты, основания, соли с точки зрения теории электрической диссоциации.
1. Кислоты– это электролиты в водных растворах, которых всегда присутствуют катионы H (протоны); это электролиты, которые диссоциируют катион водорода (H+ - HCl, HNO3, H2SO4) и анион кислотного остатка.
HCl→H++Cl-
HNO3→ H++ NO3-
Многоосновные кислоты (серная, фосфорная) диссоциируют ступенчато.

Кислыми считаются растворы, в которых присутствуют катионы водорода. Протоны в воде гидротируются 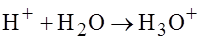 с образованием иона гидраксония.
с образованием иона гидраксония.
2. Основания– это электролиты, которые при диссоциации образуют анион гидроксильной группы OH- и катион металла 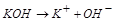 ; это электролиты, в водных растворах которых присутствуют анионогидраксильной группы (OH – гидроксильный анион) и катионы Me (
; это электролиты, в водных растворах которых присутствуют анионогидраксильной группы (OH – гидроксильный анион) и катионы Me ( 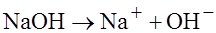 ). Растворы гидроксидов, щелочных и щелочноземельных металлов называют щелочами. В них всегда присутствует OH и в целом водные растворы, в которых присутствует гидроксид-ион, называют щелочными.
). Растворы гидроксидов, щелочных и щелочноземельных металлов называют щелочами. В них всегда присутствует OH и в целом водные растворы, в которых присутствует гидроксид-ион, называют щелочными.
3. Соли– это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
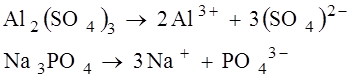 .
.
Дата добавления: 2015-08-08; просмотров: 1538;
