Слабые электролиты.
К слабым электролитам относятся: вода, гидроксид аммония, основания, образованные всеми другими металлами, кроме щелочных и щелочноземельных, органические кислоты ( пример: CH3COOH), некоторые минеральные кислоты (пример: H2S, H2CO3).
В водных растворах таких электролитов при данной температуре и концентрации электролита устанавливают равновесие между ионной и молекулярными формами электролита, то есть процесс диссоциации обратим.
Пример: 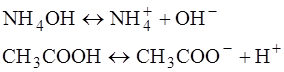
Наряду с диссоциацией идет ассоциация (между ионной и молекулярной формой). Такое равновесие характеризуется величиной константой равновесия (или константа диссоциации).

Кд слабых электролитов можно найти в справочных таблицах.
Закон разбавления Оствальда.
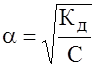
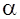 - степень диссоциации электролита;
- степень диссоциации электролита;
С – концентрация электролита.
Он дает возможность рассчитать 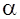 при его заданной концентрации
при его заданной концентрации
Ионное произведение воды. Водородный показатель.
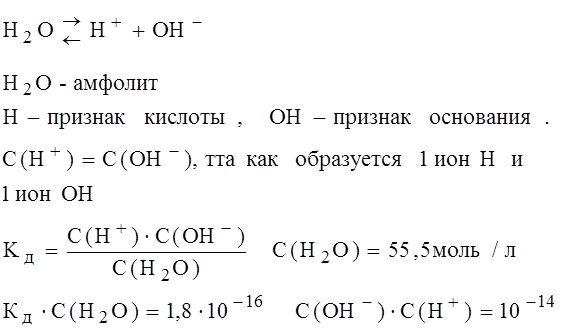
Произведение концентрации ионов водорода и концентрации гидродных групп называют ионным произведением воды, для стандартных условий есть величина постоянная, равная 10-14 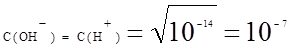
Водородный показатель (pH)
pH= -lgC(H+) pH= -lg10-7
Если в воде растворить кислоту, равновесие смещается в сторону ассоциации, а ионное произведение воды остается постоянным.
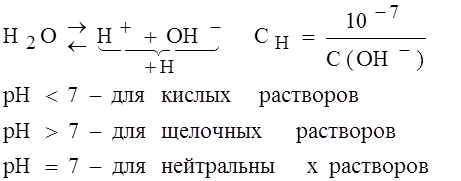
Учитывая, что вода чаще всего используется в качестве среды для многих реакций, протекающих в природе, технике, быту и живых организмах принято говорить о кислой, щелочной и нейтральной реакции среды, характеризуя ее по значению pH. Величину pH можно определить электрохимическим путем с помощью потенциометра. Кроме того, величину pH можно определить с помощью кислотно-щелочных индикаторов- это органические соединения, окраска которых изменяется в зависимости от концентрации ионов водорода в водном растворе. К ним относятся: лакмус, фенолфталеин (бесцветный до pH=9, pH>9 – малиновый), метилоранж (желтый до pH>5, 3<pH<5 – оранжевый, pH<3 – красный). На практике используется универсальный кислотно-щелочной индикатор, с помощью которого pH можно измерить с точность до 1. Его окраска изменяется от красного до светло зеленого в нейтральной среде, и фиолетовый в щелочной среде. Частота этой окраски зависит от частоты вещества.
Дата добавления: 2015-08-08; просмотров: 880;
