Структура металла.
В узлах кристаллической решетки находятся катионы металла, все атомы металла удерживаются внешними валентными относительно свободными электронами – электронный газ, именно они обуславливают физические (электропроводность, теплопроводность, пластичность) свойства металла, а также его химические свойства (восстановительные). Эти электроны удерживают все атомы в данной массе металла вместе, то есть они осуществляют так называемую металлическую связь.
Металлическая связь – это связь между всеми атомами металлов осуществляемая за счёт всех валентных электронов атомов данной массы металла. Как и ковалентная данная связь осуществляется за счёт валентных электронов. Длина такой связи, её энергия не могут являться характеристикой связи, но по их величине можно судить по характеристикам кристаллической решётки металлов (например, расстояние между атомами или энергия кристаллической решётки).
Металлическая связь не насыщена, не направлена т. к. ею связано n-ное число атомов. Именно электроны, образовавшие металлическую связь, обуславливают физические и химические свойства металлов. Физические: электропроводность, теплопроводность, пластичность; химические: способность отдавать электроны (все металлы восстановители, но безусловно их восстановительные свойства для каждого индивидуальны и могут быть количественно оценены). Электролиты – это водные растворы кислот, оснований, солей, содержащие катионы и анионы, которые обуславливают их теплопроводность.
При введении в контакт металла и электролита имеет место обмен между твердой и жидкой фазой катионами металла, следовательно, катионы металла из электролита будут переходить в металл или из металла в электролит; следовательно, будет иметь место окисление металла или его восстановление, а также возникает скачек электрического потенциала, то есть появится разность потенциалов между металлической пластинкой и прилегающим слоем электролита, величена которой зависит: от природы металла, от температуры и от концентрации электролита.
С течением времени в такой системе устанавливается равновесие между окислительной и восстановительной формой металла. Этому состоянию будет соответствовать определённое значение разности потенциалов между металлической пластиной и прилегающим слоем электролита.
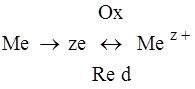
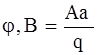 - электродный потенциал (окислительно-восстановительный потенциал).
- электродный потенциал (окислительно-восстановительный потенциал).
Если стандартизировать условия электродного потенциала то его можно использовать в качестве характеристики окислительно-восстановительных свойств металла для реакции, протекающих в электролитах.
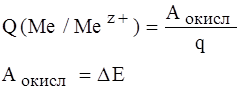 , где
, где
q – число отданных и принятых электронов;
Если z=1, то q=N*e*z; q=N*e, где N=NA=6.02*1023, e=1.6*10-19Кл.
q=N*e=96500Kл.=F
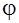 (Me/Mez+)=
(Me/Mez+)= 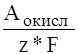
Физический смысл: количество, которое необходимо для окисления или восстановления одного моль атомов или ионов при z=1.
Для сравнения потенциалов различных металлов вводится понятие стандартный электродный потенциал – это потенциал, измеренный при стандартных условиях t=298К, P\101кПа.
Зависимость электродного потенциала от температуры и концентрации электролита выраженного уравнением Нернста.
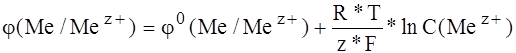 , где
, где
 -электродный потенциал металла при данных условиях;
-электродный потенциал металла при данных условиях;
 - стандартный электрический потенциал;
- стандартный электрический потенциал;
z – заряд катиона;
F – число Фарадея.
Если считать T=298К и учесть значение R и F, а также перейти от натурального логарифма к десятичному, то уравнение Нернста позволит рассчитать электродный потенциал при данной концентрации электрода в стандартных условиях примет следующий вид.
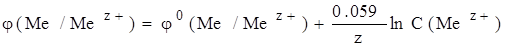
Дата добавления: 2015-08-08; просмотров: 655;
