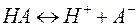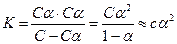Слабые электролиты. Слабые электролиты не полностью диссоциированы в растворе
Слабые электролиты не полностью диссоциированы в растворе. Существует равновесие между диссоциированной частью и недиссоциирующими молекулами:
|
Так как в растворах слабых электролитов концентрации ионов невелики, для расчетов мы можем пользоваться концентрацией ионов, а не их активностью.
Степень диссоциации слабого электролита a - это отношение числа распавшихся на ионы молекул к общему числу молекул:
|
Степень диссоциации зависит от природы электролита и растворителя, от концентрации и от температуры.
Как для всякой обратимой реакции, для уравнения электролитической диссоциации слабого электролита мы можем написать выражение для константы равновесия:
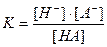 , которая является константой электролитической диссоциации.
, которая является константой электролитической диссоциации.
Константа электролитической диссоциации не зависит от концентрации вещества, а зависит только от температуры и природы веществ.
Если концентрация [HA] = C, то [H+] = [A-] = Cα
|
Для растворов с небольшой концентрацией a < 0,1 и К » Сa2, тогда 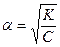 - это выражение - закон разбавления Оствальда или закон действующих масс для растворов слабых электролитов. Согласно этому закону при разбавлении раствора (уменьшении концентрации) степень диссоциации увеличивается. Степень диссоциации увеличивается также и при увеличении температуры раствора.
- это выражение - закон разбавления Оствальда или закон действующих масс для растворов слабых электролитов. Согласно этому закону при разбавлении раствора (уменьшении концентрации) степень диссоциации увеличивается. Степень диссоциации увеличивается также и при увеличении температуры раствора.
Дата добавления: 2015-08-08; просмотров: 702;