Сильные электролиты
В растворах сильных электролитов находится большее количество ионов, чем в растворах слабых электролитов, поэтому в них заметно сказывается электролитическое взаимодействие ионов друг с другом, что приводит к отклонению растворов от идеальных.
Сильные электролиты в растворе полностью диссоциированны на ионы.
В растворе каждый ион окружен ионами противоположного знака, так называемой ионной атмосферой, которая перемещается вместе с центральным ионом и ограничивает его подвижность.
Для характеристики сильного электролита вводится понятие эффективной концентрации ионов, называемой активностью.
Между аналитической концентрацией ионов данного вида «с» и их активностью «а» существует соотношение 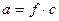 , где f – коэффициент активности.
, где f – коэффициент активности.
Коэффициент активности суммарно отображает различные взаимодействия в растворе электролита (взаимодействие ионов между собой, гидратация ионов, ассоциация и др.).
При бесконечном разведении f = 1; а = с.
Коэффициент активности зависит от ионной силы I раствора и связан с нею уравнением :
 , где
, где 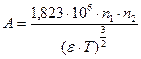
n1 n2 – заряды ионов
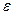 - диэлектрическая проницаемость среды
- диэлектрическая проницаемость среды
Т – температура
I - ионная сила
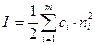
Пример: Рассчитать ионную силу раствора, содержащего 0,01 моля CaCl2 и 0,1 моля Na2SO4 в 1000 г воды (с – молярная концентрация)
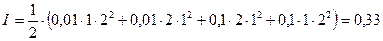
Чем выше ионная сила раствора, тем больше в нем растворимость трудно растворимых соединений.
Дата добавления: 2015-08-11; просмотров: 712;
