РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролиты – химические вещества и системы, в которых перенос электронов осуществляется движением ионов. Различают сильные и слабые электролиты. В растворе электролиты обратимо распадаются на ионы.
Законы Рауля и Вант-Гоффа применимы к идеальным или сильно разбавленным растворам электролитов и не электролитов в воде.
В реальных растворах происходит ассоциация молекул и ионов и диссоциация молекул электролитов.
Уравнения Рауля и Вант-Гоффа применимы к идеальным растворам и растворам неэлектролитов только после введения поправочного коэффициента, который называется изотоническим коэффициентом i.
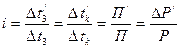 ,
,
где показатель со штрихом характеризует экспериментально полученное значение величины; знаменатель – величина, вычисленная для раствора неэлектролита той же концентрации.
Тогда закон Вант-Гоффа будет иметь вид:
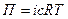
i > 1 для электролитов.
Дата добавления: 2015-08-11; просмотров: 787;
