ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Вода , очищенная от посторонних примесей обладает электрической
проводимостью, заметно возрастающей с повышением температуры (при 273
К удельная электрическая проводимость воды составляет 1,5 • 10 -8 Ом-1 • см-1,
при 289 К - 6,2 • 10 -8 Ом-1 • см-1).
Наличие электрической проводимости может быть объяснено тем, что молекулы воды, частично распадаются на ионы, т. е. Н2О является слабым электролитом.
Процесс диссоциации воды происходит по уравнению:
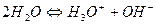
Свободных ионов Н+ в воде не существует, в связи с их гидратацией образуется ион гидроксония 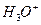 .
.
Для простоты запишем уравнение диссоциации:
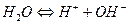

Константа диссоциации 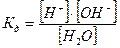 =
= 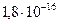
Молекулярная масса воды 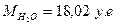 ,
,
Число молей воды в 1 литре раствора 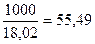
Ионное произведение воды Кw = const при постоянной температуре t=const
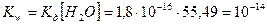
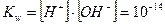
В чистой воде в нейтральном растворе концентрация ионов водорода равна концентрации ионов гидроксила: 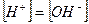 , тогда
, тогда
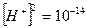 ;
; 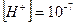 ;
; 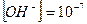
В кислой среде [H+]>10-7
В щелочной среде [H+]<10-7
Для удобства пользуются значением отрицательного логарифма концентрации ионов водорода :
pH = - lg [H+]=7
pOH = - lg [OH-]=7
Процесс диссоциации воды – эндотермический, происходит с поглощением тепла по реакции:

При повышении температуры Кд увеличивается, степень диссоциации увеличивается; при t=500С - 
рН = 6,63, рН изменилась, а среда осталась нейтральной
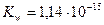 при 00С, рН = 7,97.
при 00С, рН = 7,97.
В соответствии с теорией электролитической диссоциации ионы Н+
являются носителями кислотных свойств, а ионы ОН- носителями основных свойств.
Водородный показатель определяет характер реакции раствора. Значение
рН = 7 соответствует нейтральному раствору только при 295 К (22 С).
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН __ непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов выше (рН ниже).
Для оснований подобная зависимость имеет обратный характер.
Водородный показатель играет важную роль в жизнедеятельности организма, так в норме рН сыворотки крови равен 7,40 + 0,05, слез -7,4 ± 0,1, слюны - 6,35 - 6,85, желудочного сока - 0,9 - 1,1 Отклонение рН от нормальных значений приводит к расстройству деятельности организма.
Существенно влияние на урожайность оказывает рН почвы, на экологию водоема - рН воды.
Пример 1:
Определить концентрацию [OH-] в растворе, если рН = 2, при t=250С
pH = - lg [H+]; [H+]= -10-2
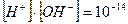
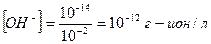
Пример 2.Определите концентрацию ионов ОН- в 0,01 М NH4OH. Рассчитайте рН этого раствора при 295 К.
Решение. Гидроксид аммония - слабый электролит и диссоциирует обра-
тимо: NH4OH =NH4+ + ОН-.
В соответствии с законом Оствальда степень диссоциации аравна
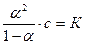 К= 1,8 10 -5
К= 1,8 10 -5
Подставляя значение К , получаем:
 а=4,24 10 -2
а=4,24 10 -2
Равновесная концентрация ионов ОН- равна
[ОН -] = ас = 4,24 • 10 -2 * 10 -2 = 4,24 • 10 - 4 моль/л.
Можно считать, что в растворе слабого электролита активность ионов равна их концентрации,
тогда
р ОН = -lg [ОН] = -lg 4,24 • 10 -4 = 3,37.
Соответственно рН = 14 - 3,37 = 10,63.
Пример 3.Рассчитайте рН раствора, содержащего 0,01 моль/л НС1 и 0,01 моль/л СаС12.
Решение. Так как НС1 и СаС12 сильные электролиты, то они диссоциируют полностью:
НС1 = Н+ + С1- , СаС12 = Са2+ + 2С1-
Соответственно рН раствора определяем по формуле
pH = -lg а=-lg f [H+].
Для расчета коэффициента активности необходимо определить ионную силу раствора
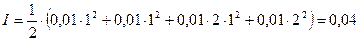
На основании табличных данных f = 0,86, следовательно,
рН = -lg (0,86 * 0,01) = 2,07.
Дата добавления: 2015-08-11; просмотров: 1029;
