Явление осмоса. Закон Вант-Гоффа.
При соприкосновении двух растворов различной концентрации, разделенных полупроницаемой мембраной происходит самопроизвольный перенос вещества из одной фазы в другую. Это явление называется осмосом.
Осмос обусловлен стремлением молекул растворителя выровнять свою концентрацию по обе стороны мембраны.
Осмос количественно характеризуется осмотическим давлением.
Осмотическое давление равно тому внешнему гидростатическому давлению, которое необходимо приложить к системе, чтобы осмос прекратился.
Изучая осмотическое давление различных растворов Вант-Гофф (1852-1911г.) пришел к выводу, что растворенное вещество ведет себя в растворе подобно газообразному веществу, оно стремится занять весь объем растворителя, так же как газ, заключенный в определенную емкость.
Вант-Гофф предложил для вычисления осмотического давления пользоваться уравнением идеального газа
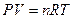
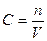
С – концентрация растворенного вещества , моль/л;
n – число молей растворенного вещества;
V – удельный объем, л;
Р – П-осмотическое давление, атм.
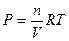
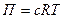
Согласно этому уравнению: одномолярный раствор недиссоциирующего вещества обладает при 00С осмотическим давлением равным 22,4 атм.
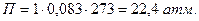
R = 8,314 Дж/моль К
Дата добавления: 2015-08-11; просмотров: 1142;
