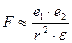Растворы электролитов.
В предыдущей лекции мы познакомились с законами, которым подчиняются разбавленные растворы. Справедливость этих законов подтверждается результатами многих экспериментов. Однако имеются вещества, растворы которых сильно отклоняются от всех рассмотренных законов. К подобным веществам относятся соли, кислоты и щелочи. Водные растворы этих веществ обладают еще одной особенностью – они проводят электрический ток. С. Аррениус (1887г.) обратил внимание на тесную связь между способностью растворов солей, кислот и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Рауля и Вант-Гоффа. Аррениус предположил, что при взаимодействии растворимого вещества с растворителем происходит ионизация частиц растворяемого вещества.
Распад вещества на сольватированные ионы под действием молекул растворителя называется электролитической диссоциацией.
Вещества, которые при растворении образуют заряженные частицы, называются электролитами (это проводники электрического тока второго рода, а проводники электрического тока первого рода – металлы). Их делят на сильные и слабые электролиты.
К сильным электролитам относят: кислоты -
HCl, HNO3, H2SO4, HСlO4, гидроксиды щелочных и щелочноземельных металлов, все растворимые в воде соли.
К слабым электролитам относятся: органические кислоты, минеральные кислоты: HCN, H2S,H3PO4 и др. плохо растворимые в воде основания и соли.
Способность к электролитической диссоциации зависит не только от самого электролита, но и от растворителя.
По закону Кулона электростатическое притяжение (F) двух разноименных зарядов (e1 и е2), расстояние между которыми r
|
 |
e – диэлектрическая проницаемость среды – показывает во сколько раз силы взаимодействия между зарядами в данной среде меньше, чем в вакууме, т.е. чем больше диэлектрическая проницаемость среды, тем слабее взаимодействуют между собой частицы, тем вероятнее произойдет ионизация молекул.
Самой высокой диэлектрической проницаемостью обладает вода. Именно поэтому в водной среде максимально ослабляется электростатическое притяжение разноименно заряженных ионов. В растворителях с малой диэлектрической проницаемостью ионы продолжают достаточно сильно притягиваться друг к другу, оставаясь в виде ионных пар. Большая диэлектрическая проницаемость воды не является единственной причиной ее высоеого ионизирующего действия. Дипольный характер молекул воды, обладающих неподеленными электронными парами, обусловливает ее значительную спосоьность к образованию гидратированных ионов за счет донорно-акцепторного взаимодействия, а выделяющаяся при этом энергия гидратации ионов компенсирует энергию, необходимую для преодоления сил электростатического притяжения ионов в кристаллической решетке вещества.
Дата добавления: 2015-08-08; просмотров: 719;