ВОДА И ВОДНЫЕ РАСТВОРЫ
1.Вода как химическое соединение.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, имеет и имеет простую на первый взгляд формулу Н2О. Молекула воды имеет следующее строение:
 Н
Н
О ) 104,50
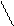 0,96 А0
0,96 А0
Н
Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О - Н 0,0957 нм ( 0,96 А° ), угол между связями О - Н 104,5 °, энергия ионизации 12,6 эВ.
|
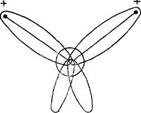
Направленность химических связей и распределение электронных плотностей в молекуле воды можно объяснить электростатическим взаимодействием между атомами водорода при образовании связей О-Н и гибридизацией s- и р- электронных орбиталей атома кислорода. Электронное облако молекулы воды имеет вид четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О-Н, а в двух вершинах противоположной грани находятся не поделенные электронные пары атома кислорода. Электронное облако в молекуле воды смещается к атому кислорода, т.к. он имеет большую электроотрицательность. Вследствие этого вблизи ядер атомов водорода создается избыток положительного заряда, поэтому молекула воды полярна.
|
Рис. 1 Электронное облако Рис. 2 Электронные орбитали
молекулы воды молекулы воды
Полярные молекулы характеризуются электрическим моментом диполя, для воды он равен 1,84 дебая. Благодаря наличию дипольного момента между молекулами воды проявляется сильное взаимодействие с образованием водородной связи.
Водородная связь возникает в результате внедрения очень малого по размерам положительно поляризованного атома водорода одной молекулы в электронную оболочку отрицательно поляризованного атома кислорода другой молекулы воды. Длина водородной связи О...Н изменяется в пределах от 0,14 до 0,2 нм, энергия ее составляет 17-33 кДж/ моль.
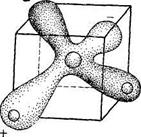
Структура льда гексагональная (структура тетраэдра  пустоты
пустоты 
 )
)

 Н Н
Н Н
О

 Н Н
Н Н
 О – Н
О – Н  О
О
 Н
Н

 Н
Н  Н
Н
 О – Н О
О – Н О
Н
2. Физические свойства воды.
Чистая вода представляет собой бесцветную ( в тонком слое ) или голубовато-зеленую (в толстом слое) прозрачную жидкость , не имеющую ни запаха ,ни вкуса .Вода- единственный на Земле минерал, который может находиться одновременно в трех агрегатных состояниях: твердое, жидкое и газообразное.




 О … Н Н … О
О … Н Н … О
Н Н … О … Н Н …
Масса одного мл очищенной воды принята за единицу массы и называется граммом.
Молекулярная масса воды, у.е. 18,0154.
Плотность жидкой воды, г/ см 0,998
Теплота образования, кДж/ моль
пар 241,985
жидкая 286,031
Теплота плавления, кДж / моль 6,012
Теплота испарения, кДж/ моль 44,041
Удельная теплоемкость, кДж/кг х град
Льда 2,039
Жидкой воды 4,187
Пара 3,039
Теплопроводность, Вт/ м х К
Льда 2,34
Жидкой воды ( 20°) 0,598
Пара (100°) 0,645
Плотность льда , г/ см3 0,9168
Поверхностное натяжение, Н / м2 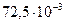
Приведенные физические константы относятся к одному изотопу воды Н216О. В природе встречаются другие устойчивые изотопы водорода ( дейтерий и тритий) и кислорода ( протий 17О, 18О ). Только с учетом протия и дейтерия можно получить следующие изотопы воды: Н216О; HD 16O; D2 16О; Н217О; D217O; HD17O; H218O; HD18O. Наибольшее применение из перечисленных изотопов имеет тяжелая вода D216O.
3. Аномальные свойства воды.
Все аномальные свойства воды связаны с особенностями строения ее молекулы и способностью образовывать молекулярные агрегаты или ассоциированные молекулы (Н 2 О)n.
3.1.Существованием водородных связей объясняется аномально высокая температура плавления воды по сравнению с водородными соединениями аналогов кислорода (Тпл для Н2 S -60,3°С , для Н2Те -51°С, для H2Se-65,7°C)
3.2. В зависимости от температуры и давления , при которых происходит формирование кристаллической фазы, различают 13 видов льда. При обычных условиях устойчивым является лед, имеющий гексагональную структуру, каждая молекула воды тетраэдрически окружена четырьмя другими, образующими с ней водородные связи. Подобное соединение молекул воды друг с другом способствует образованию пустот в кристаллической решетке льда, объясняя аномально малую плотность воды в твердом состоянии.
3.3 При нагревании от 0°С до 4°С объем воды не увеличивается а уменьшается и максимальная плотность ее достигается не в точке замерзания , а при 4°С.
В твердом состоянии в результате образования тетраэдрических комплексов объем увеличивается примерно на 10%. При плавлении льда нарушается его регулярная структура, что сопровождается увеличением плотности.
3.4 Температура замерзания воды с увеличением давления понижается ,а не повышается, как этого следовало бы ожидать.
3.5 Удельная теплоемкость воды чрезвычайно велика по сравнению с теплоемкостью других тел.
З.6 Вследствие высокой диэлектрической проницаемости ( 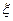 >15) и наличия дипольного момента, вода обладает высокой растворяющей и диссоциирующей способностью.
>15) и наличия дипольного момента, вода обладает высокой растворяющей и диссоциирующей способностью.
3.7 Вода обладает самым большим поверхностным натяжением из всех жидкостей (75 эрг /см 2), за исключением ртути (436 эрг/ см).
3.8 Вода, по сравнению с другими жидкостями имеет наибольшую теплоту испарения и теплоту плавления.
Аномальные свойства воды играют огромную роль в природе и формировании климата на Земле. Малая теплопроводность льда защищает водоемы от промерзания и способствует сохранению жизни на Земле в суровых климатических условиях северных регионов. Хорошей защитой водоемов является и снег, теплопроводность которого соответствует теплопроводности шерсти при плотности 0,1 г/см3 и теплопроводности бумаги при плотности 0,2 г/см3.
Высокая теплоемкость воды способствует сглаживанию температурных перепадов в жарких и холодных районах, благодаря возникновению огромных теплых и холодных океанических течений. Массы воды океанов и морей служат гигантским тепловым аккумулятором Земли. Кроме того высокая теплоемкость воды способствует поддержанию нормальной температуры тела у теплокровных организмов при переходе из одной температурной обстановки в другую.
Аномально высокая величина поверхностного натяжения воды играет важную роль в протекании биохимических процессов как в организме человека , так и в окружающей нас природе (смачиваемость , капиллярный эффект ).
Самая высокая величина диэлектрической проницаемости воды (81 ) по сравнению с другими жидкостями определяет ее самую большую растворяющую способность в отношении веществ с полярной и ионной структурой.
4.Химические свойства воды.
Вода весьма реакционноспособное вещество, взаимодействует с окислами металлов и неметаллов, способна входить в состав координационных соединений в виде лигандов. Вода
Подвержена электролитической диссоциации по следующим схемам:
Н2О = Н+ + ОН-
По такой схеме диссоциирует 1 молекула из 5 х 109 молекул. Протон Н + взаимодействует с молекулой воды, образуя ион гидроксония:
Н+ + Н2О = Н3О +
Ион гидроксония в свою очередь взаимодействует с молекулой воды, образуя гидратированный ион гидроксония Н5О2.
Существование гидратированных ионов играет важную роль в химических процессах, протекающих в различных системах, в том числе биологических.
4.1 Синтез воды.
Н2 + 1/2 О2 = Н2О - 242 кДж/ моль( для пара), 286 кДж / моль (для воды)
При низких температурах в отсутствие катализатора реакция протекает крайне медленно, при повышении температуры до 550°С реакция происходит со взрывом.
4.2 Взаимодействие воды с окислителями.
Вода окисляется атомарным кислородом с образованием перекиси водорода:
Н2О+О=Н2О2;
4.3.Взаимодействие с галогенами.
Н2О + С12 = Н С1 +Н С1О при низких температурах;
2 Н2 О + С12 = 4 Н С1 + О 2  ; при повышенных температурах.
; при повышенных температурах.
4.4 Взаимодействие с углеродом. При пропускании паров воды через раскаленный уголь образуется так называемый водяной газ:
Н2О + С = СО  + Н2
+ Н2 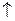 ;
;
4.5. Взаимодействие с соединениями углерода.
Н2О + СО = Н2 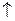 + СО2
+ СО2 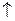
Н2О + СН4 = 3H2 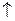 + СО
+ СО 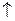 (катализаторы Ni или Со).
(катализаторы Ni или Со).
Эти реакции используются для промышленного получения водорода.
4.6. Взаимодействие с фосфором.
Фосфор при нагревании с водой под давлением в присутствии катализатора взаимодействует с водой с образованием метафосфорной кислоты.
6 Н2О + 3 Р = 2 НРОз + 5 Н2 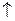
4.7. С металлами
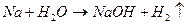


Дата добавления: 2015-08-11; просмотров: 1456;
