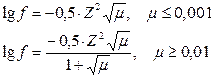Сильные электролиты. Для сильных электролитов характерна полная диссоциация на ионы в растворе:
Для сильных электролитов характерна полная диссоциация на ионы в растворе:
AB = A++B-.
В растворе образуются гидратированные ионы вещества. Между заряженными частицами существует электростатическое взаимодействие.
Активность иона:
a = f×c,
где a – активность иона,
c - молярная концентрация, моль/л
f - коэффициент активности, л/моль
Активность – это доля общего числа ионов, которая влияет на электрическую проводимость раствора, давление пара, температуру кристаллизации, кипения и другие свойства раствора. Активность зависит не только от концентрации одного иона, но и от концентрации других ионов, находящихся рядом. Чтобы учесть влияние других ионов, находящихся рядом, вводят понятие ионная сила растворов (m).

где Cm – моляльные концентрации ионов (это количество молей растворенного вещества в одном литре растворителя), Z – заряд иона.
Пример: Вычислить ионную силу 0,01М раствора Ca(NO3)2 , к 1л которого добавили 0,05моль NaCl .
Ca(NO3)2 ® Ca2+ + 2NO3-;
0,01 0,02
NaCl ® Na+ + Cl-
0,05 0,05
[Ca2+] = 0,01; [NO-3] = 0,02; [Na+] = 0,05; [Cl-] = 0,05
m = 1/2(0,01×22 + 0,02×12 +0,05×12 + 0,05×12) = 0,08
При одной и той же ионной силе m коэффициент активности f зависит от заряда иона. Ионы с высоким зарядом обладают повышенной способностью к образованию ионных ассоциатов, поэтому их коэффициент активности снижается. В разбавленных растворах с одинаковой ионной силой коэффициенты активности ионов, обладающих одинаковыми зарядами, примерно одинаковы.
Пример: Вычислить ионную силу раствора и активность ионов меди в 0,025M растворе CuSO4.
CuSO4 = Cu2+ + SO42-
m = 1/2×(0,025×22 + 0,025×22) = 0,1
f = 0,33 – из таблицы
a(Cu2+ )= a(SO42- ) = 0,33×0,025 = 8,25×10-3
Для очень разбавленных растворов зависимость коэффициента активности от ионной силы раствора выражается уравнением Дебая-Гюккеля:
|
Дата добавления: 2015-08-08; просмотров: 675;