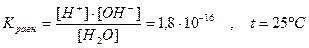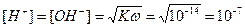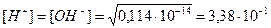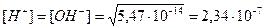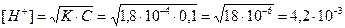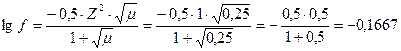Вода. Водородный показатель.
Вода является весьма слабым электролитом, ее диссоциация выражается уравнением
H2O « H+ + OH-
H+ + H2O « H3O+
Свободных ионов водорода в воде нет.
[H2O] = C исх
С исх = 1000г/18г = 55,55 моль/л. – концентрация воды.
Кравн. × [H2O] = const = [H+]×[OH-] = 1,8×10-16×55,55 = 1×10-14
|
т.е. [H+]×[OH-] = 1×10-14 = Kw - ионное произведение воды.
В любом растворе присутствуют как ионы водорода, так и ионы гидроксила, но в разных количествах.
Нейтральная среда:
|
Кислая среда:
[H+] > 10-7 , т.е. [H+] = 10-6; 10-5
[OH-] = 10-8; 10-9
Щелочная среда:
[H+] < 10-7 , т.е. [H+] = 10-8; 10-9;10-10
[OH-] = 10-6; 10-5; 10-4
Водородный показатель среды:
pH = - lg[H+]; pOH = - lg[OH-]
В нейтральной среде: pH = 7 = pOH.
В кислой среде: pH < 7; pOH > 7.
В щелочной среде: pH > 7; pOH < 7.
pOH = 14 – pH
Ионное произведение воды зависит от температуры, так как степень диссоциации воды зависит от температуры.
При t = 0°; Kw = 0,114×10-14
|
pH = - lg[H+] = 7,47; т.е. при 0° - pH нейтральной среды > 7.
При t = 50°
|
pH = 6,63
Пример 1:
Расчет водородного показателя:
См = 0,1 М
Ккисл = 1,8×10-4

Вычислить pH в водном растворе муравьиной кислоты:
|
pH = - lg 4,2×10-3 = 2,38 – кислая среда.
Для слабых электролитов можно использовать концентрацию ионов, а не понятие активности.
Пример 2:
Вычислить рН в 0,25М растворе хлорной кислоты.
Хлорная кислота – сильный электролит, следовательно для расчетов нужно использовать активность ионов , а не концентрацию.
HClO4 = H+ + ClO4-
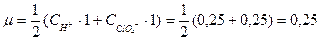
|
f = 0,681.
аH+ = f×[H+] = 0,25×0,681 = 0,17
pH = - lg0,17 = 0,77 – очень кислая среда.
Дата добавления: 2015-08-08; просмотров: 831;