Водородный показатель. Расчет рН растворов кислот и оснований
Для удобства вычислений и построения графиков, выражающих зависимость какого-либо свойства от концентрации ионов водорода, был введен символ рН –водородный показатель — это десятичный логарифм активности водородных ионов, взятый с отрицательным знаком:
pH= -Ig[H+], аналогично рОН=-Ig[ОH-];
Логарифмируя уравнение получаем : -Ig[H+]+(-Ig[ОH-])= -IgКW=-Ig110-14
или рН+рОН=14.
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
При вычислении рН раствора сильной кислоты или сильного основания необходимо знать молярную концентрацию ([Н+] или [ОН]) эквивалента данного вещества и коэффициент активности (γ или f) соответствующего иона (γ(Н+) или γ (ОН)) в заданном растворе.
Для расчетов используют следующие уравнения:
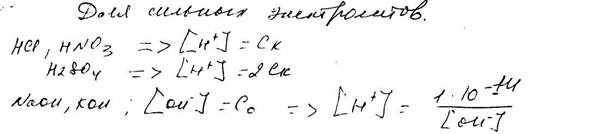
При вычислении рН раствора слабой кислоты или слабого основания необходимо знать молярную концентрацию данного вещества [Н+] или [ОН] и константу его диссоциации (Кд):

Тема «Буферные системы (растворы)»
1. Классификация буферных систем
2. Механизм действия буферных систем
3. Расчет показателя рН буферных систем. Уравнение Гендерсона –Хассельбаха.
4. Буферная емкость. Факторы, определяющие буферную емкость
5. Буферные системы крови и слюны
Буферная система— это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при незначительных внешних воздействиях.
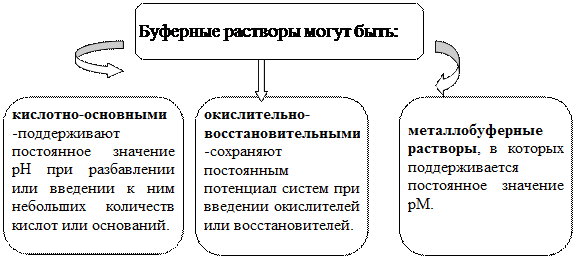
1. Классификация кислотно-основных буферных систем:
1) слабая кислота и ее анион НА/А-; например: ацетатная буферная система СН3СООН/СН3СОО-; H2CO3/HCO-;
2) слабое основание и его катион В/ВН+; например: аммиачная буферная система NH3/NH4+;
3) анионы кислой и средней соли или двух кислых солей; например: карбонатная буферная система СО32-/НСО3; фосфатная буферная система НРО42-/Н2РО4-;
4) ионы и молекулы амфолитов; к ним относят аминокислотные и белковые буферные системы:
а) слабая белок-кислота и соль этой слабой кислоты:
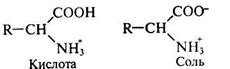
б) слабое белок-основание и соль этого слабого основания:
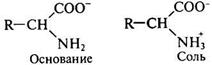
В протолитических (т.е. протонной) буферных растворах компонентами являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару. В качестве донора протона выступает слабая кислота (СН3СООН, H2CO3) или сопряженная кислота слабого основания (NH4+). Акцептором протона в первом случае является анион слабой кислоты (СН3СОО-, НСОз-), а во втором - слабое основание (NH3 Н2О).
Универсальная буферная смесь(готовят, смешивая растворы ортофосфорной, уксусной и борной кислот с раствором гидроксида натрия), которая позволяет поддерживать постоянство рН при заданном значении в широком интервале рН = 1,81—11,98.
Следует отметить, что не только смеси, но и растворы некоторых индивидуальных солей, например, тетрабората натрия, карбоната аммония и др., также обладают буферными свойствами.
Дата добавления: 2015-08-08; просмотров: 4193;
