Механизм действия буферных систем и расчетные формулы для определения рН в этих растворах
Для объяснения механизм поддержания рН на одном уровне воспользуемся ацетатным буферным раствором (CH3COONa– как сильный электролит в водном растворе распадается на ионы нацело и СНзСООН –как слабый электролит – лишь частично). В такой смеси протекают следующие реакции
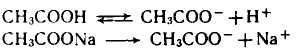
Первая из реакций оказывается почти полностью подавленной из-за большой концентрации ацетат-ионов, вызванной диссоциацией сильного электролита — ацетата натрия.
А) Если к такому раствору добавить сильную кислоту, то ионы водорода будут взаимодействовать с анионами с образованием молекул СНзСООН и реакция среды не измениться, т.е. рН≈const.
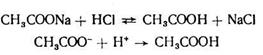
Б) Если к раствору добавлять сильное основание, то гидроксид-ионы будут взаимодействовать с ионами водорода (или с молекулами СН3СООН), хоть и в небольшом количестве, но содержащимися в растворе. Образование воды не влияет на реакцию среды. Пошедшие на реакцию с ОН- ионы водорода будут компенсированы за счет смещения равновесия реакции диссоциации СН3СООН вправо.
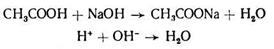 рН≈const.
рН≈const.
Для системы аммиачной буферной системы NH3/NH4+ (самостоятельно на практике);
Дата добавления: 2015-08-08; просмотров: 1311;
