Направление протекания окислительно-восстановительных процессов
Предсказать направление окислительно-восстановительных реакций дает возможность второй закон термодинамики.
Условием протекания окислительно-восстановительной реакции в прямом направлении, как и любой другой является изменение энергии Гиббса DG<0. Например, возможно протекание реакции в прямом направлении:
Mg + H2O(ж) ® MgO + H2 , DG= - 94,5 кдж/моль
и невозможно для реакции:
Pd + H2O(ж) ® PbO + H2 , DG= 126,5 кдж/моль
Считать изменение энергии Гиббса DG для окислительно-восстановительных реакций дело трудоемкое.
С другой стороны, DG, как известно, определяет работу химической реакции, в данном случае работу по переносу электронов.
Процессы непосредственного превращения химической энергии в электрическую и обратно называются электрохимическими процессами. Их можно разделить на две группы:
1) процессы превращения химической энергии в электрическую (работа гальванических и топливных элементов, разрядка аккумулятора, выработка электричества животными);
2) процессы превращения электрической энергии в химическую (электролиз, электрическая коррозия, зарядка аккумулятора и др.).
В окислительно-восстановительных реакциях происходит переход электронов от одних молекул, атомов или ионов к другим. При этом энергия у ряда химических реакций может превращаться в теплоту.
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником.
Рассмотрим металл в растворе его соли. Возможны два процесса –
а) металл растворяется, переходит в раствор, образуя положительные ионы:
Мтв ↔ М2+aq + 2e,
при этом электроны останутся на пластине, заряжая ее отрицательно. На границе металл–раствор возникает двойной электрический слой. Между пластиной и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода. При некотором значении потенциала скорость прямого процесса будет равна скорости обратного процесса, и потенциал в таких условиях называется равновесным электродным;
б) если в качестве металла взять медь, она будет забирать электроны с пластины и заряжать ее положительно:
М2+aq+2e®Mтв.
Возникает также разность потенциалов между электролитом и пластиной, которая зависит от природы металла и от концентрации ионов.
Если две таких пластины соединить, пойдет ток, между пластинами возникает разность потенциалов. Работа такого гальванического элемента определяется разностью потенциалов:
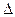 G = -z ∙ F ∙ Е, (14.1)
G = -z ∙ F ∙ Е, (14.1)
где 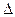 G - изменение энергии Гиббса или изобарно-изотермического потенциала, Дж/моль;
G - изменение энергии Гиббса или изобарно-изотермического потенциала, Дж/моль;
n – наименьшее общее кратное числа отдаваемых и принимаемых в реакции электронов;
F=96487 кулонов - количество электричества, необходимое для растворения или восстановления одного химического эквивалента металла или другого вещества;
Е - разность потенциалов полуреакций восстановления или электродвижущая сила (ЭДС) гальванического элемента, В;
R=8,314 ,Дж/моль ∙ К -универсальная газовая постоянная;
Т - температура по шкале Кельвина.
Дата добавления: 2015-08-08; просмотров: 1925;
