Уравнение Нернста. В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех параметров:
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех параметров:
1) от природы веществ-участников электродного процесса;
2) от концентраций (активностей) этих веществ (или ионов);
3) от температуры системы.
И эта зависимость выражается уравнением Нернста (14.5).
Критерий возможности самопроизвольного протекания электрохимической (окислительно-восстановительной) реакции – отрицательная величина 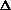 G реакции. В общем случае для реакции
G реакции. В общем случае для реакции
aA + bB ↔ cC + dD
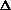 G =
G = 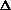 G0 + RT ln([C]c[D]d/[A]a[B]b) . (14.3)
G0 + RT ln([C]c[D]d/[A]a[B]b) . (14.3)
В положении равновесия 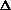 G = 0 и
G = 0 и
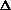 G0 = -RTlnKр . (14.4)
G0 = -RTlnKр . (14.4)
Тогда
E = - 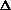 G/nF = (RT/nF)[lnKр - ln([C]c[D]d/[A]a[B]b)],
G/nF = (RT/nF)[lnKр - ln([C]c[D]d/[A]a[B]b)],
E =E0 - (RT/nF) ln([C]c[D]d/[A]a[B]b) , (14.5)
где n- число электронов, принимающих участие в полуреакции;
Kр = [C]cравн[D]dравн/[A]aравн[B]bравн - константа равновесия.
Для обычной при электрохимических измерениях стандартной температуры (25 °С = 298 К) при подстановке значений постоянных величин (R=8,31 Дж/(моль ∙ К), F=96500 Кл/грамм-эквивалент) уравнение (1.5) принимает вид:
Е = Е°298 + 0,059 / z ∙ lg(C Oic. / С восст.). (14.6)
Если в качестве электрода используют металл, погруженный в раствор его соли, то рассматриваемая формула примет вид:
Е = Е0298 + 0,059 / z ∙ lg С ок , (14.7)
так как концентрация твердой фазы (металла) принимается равной 1.
ЭДС гальванического элемента определяется как разность потенциалов восстановления электродов, причем от большего потенциала отнимают меньший:
ЭДС = Е1 (катода) - Е2 (анода). (14.8)
В уравнении Нернста, строго говоря, нужно вместо концентраций пользоваться активностями ионов.
Если разность стандартных восстановительных потенциалов невелика (не более 0,3 В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
Гальванический элемент, составленный из двух одинаковой природы электродов, которые различаются только концентрацией одноименных ионов металла в растворах, называется концентрационным.
Например, схема такого элемента, составленная из двух медных электродов, которые опущены в два раствора сульфата меди с различной молярной концентрацией имеет вид:
Сu CuSO4(10-6 М) | КСl | CuSO4(lM) | Сu.
ЭДС концентрационного элемента можно определить по формуле
ЭДС конц. гальв. эл. = 0,059 / z ∙ lg(Clок. / С2ок.). (14.9)
Дата добавления: 2015-08-08; просмотров: 722;
