Co, Ni, Sn, Pb, H , Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
При сравнении металлов в ряду напряжений за меру химической активности принимается сумма трех слагаемых: энергии атомизации, характеризующей прочность кристаллической решетки данного металла; энергии ионизации атомов - отрыва от них валентных электронов и энергии гидратации, зависящей от электронной структуры иона, его заряда и радиуса. Чем меньше радиус иона и больше заряд, тем больше энергия гидратации, так как поле возникающее вблизи маленьких ионов с большим зарядом будет больше.
Ряд напряжений характеризует химические свойства металлов:
1) чем левее расположен металл в ряду напряжений, тем сильнее его восстановительная способность и тем слабее окислительная способность его иона в растворе (т.е. тем легче он отдает электроны (окисляется) и тем труднее его ионы присоединяют обратно электроны);
2) каждый металл способен вытеснять из растворов солей те металлы, которые стоят в ряду напряжений правее его, т.е. восстанавливает ионы последующих металлов в электронейтральные атомы, отдавая электроны и сам превращаясь в ионы;
3) только металлы, стоящие в ряду напряжений левее водорода (Н), способны вытеснять его из растворов кислот (например, Zn, Fe, Pb, но не Сu, Hg, Ag).
В справочных таблицах приводят стандартные электродные потенциалы ряда металлов, показывающие возможность переноса электронов между ними. Эти данные получены для систем, содержащих водный раствор ионов металла с концентрацией (активностью) 1 М и электрод из этого металла; электрический потенциал Е определяется относительно стандарта – водородного электрода.
Записывать потенциалы можно по разному, поскольку в полуреакции заключено равновесие. Но наиболее удобно и сейчас повсеместно принято писать Ox + ne ® Red. При составлении таблицы потенциалов положительные потенциалы записываем ниже нуля (там, где DG<0), а отрицательные - по возрастанию абсолютной величины вверх.
В этой таблице сильные окислители находятся в левом нижнем углу, сильные восстановители - в правом верхнем.
Потенциал системы из двух металлов вычисляется по таблицам .
Для системы:
Zn + Cu2+ = Zn2+ + Cu
Е0 = Е0 (ок-ль) – Е0 (восст-ль) = +0,34 - (-0,76) = 1,1 В .
Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
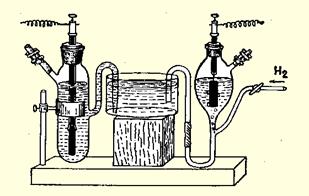
Рисунок 14.3 - Измерение потенциала металлического электрода (слева) по водородному
Помимо окислительно-восстановительных реакций, в которых атомы металла-восстановителя взаимодействуют с ионами металла-окислителя, известно множество окислительно-восстановительных реакции, где в роли окислителя выступают ионы металла, а в роли восстановителя – ионы неметалла:
2Fе3+ + 2I- = 2Fе2 + I2 ,
а также реакции, где одни анионы-окислители – окисляют, другие анионы–восстановители, например:
MnO4 - + 5 Cl =8H+ = Mn2+ +2 ½ + Cl2 + 4H2O .
Подобные окислительно-восстановительные реакции можно провести таким образом, чтобы одни ионы отдавали свои электроны другим не непосредственно, а через проводник (инертный платиновый электрод). Растворы в таких сосудах соединяют трубкой, заполненной раствором КСl, а электроды – проводником. Во внешней цепи появляется электрический ток.
В каждом из полуэлементов на границе между инертным электродом и раствором возникает разность потенциалов, называемая окислительно-восстановительным потенциалом. Последний, будучи измерен по отношению к водородному электроду, называется стандартным электродным окислительно-восстановительным потенциалом
В Приложении Б приведены значения стандартных электродных потенциалов некоторых окислительнл-восстановительных систем в водных растворах при температуре 25 0С.
Дата добавления: 2015-08-08; просмотров: 877;
