Моделирование кинетики химических и ферментативных реакций
Количественной характеристикой, определяющей динамику процесса химического превращения, является скорость реакции. Скорость химической реакции – это изменение числа молей одного из компонентов в единицу объема:
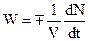 (1)
(1)
где V – объем; N – число образовавшихся или прореагировавших молей; t – время.
Вводя концентрацию вещества C как количество молей в единице объема, т.е. C = N/V, получим
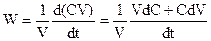 , (2)
, (2)
или
 . (3)
. (3)
Для реакций, протекающих при постоянном объеме в замкнутой системе, второе слагаемое уравнения (4.3) равно нулю. Это уравнение приводится к виду
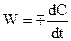 или
или 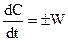 (4)
(4)
Здесь знак (+) указывает, что вещество накапливается в результате реакции, знак (–) – что концентрация вещества убывает.
Такое определение скорости химических реакций справедливо для гомогенных реакций, где все реагирующие компоненты находятся в одной фазе объемом V. Если допустить, что механизм, обуславливающий протекание реакции, заключается в столкновении или взаимодействии одной молекулы А с молекулой В, что приводит к образованию одной молекулы продукта реакции С, то число столкновений молекул А и В пропорционально скорости реакции А + В. Уравнение 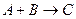 называется стехиометрическим уравнением реакции. Поскольку число столкновений при данной температуре пропорционально концентрации реагентов в смеси, то скорость исчезновения вещества А можно выразить уравнением
называется стехиометрическим уравнением реакции. Поскольку число столкновений при данной температуре пропорционально концентрации реагентов в смеси, то скорость исчезновения вещества А можно выразить уравнением
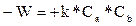 (5)
(5)
где k – константа скорости химической реакции (фактически равная скорости реакции при единичных концентрациях). Зависимость константы скорости реакции от температуры обычно выражается законом Аррениуса:
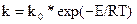 ,
,
где k0 – предэкспоненциальный множитель, зависящий от числа столкновений реагирующих молекул; Е – энергия активации, кДж/кмоль; R – газовая постоянная, кДж/(кмоль*град); Т – абсолютная температура.
Для данного вида молекул при данной температуре k = const. Скорость реакции, выраженная в степени их стехиометрических коэффициентов, называется закон действующих масс. В общем случае для реакции, в которой участвуют j компонентов с концентрацией Сj, стехиометрическим коэффициентом aj, скорость реакции можно описать соотношением
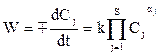
где 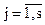 - исходные вещества.
- исходные вещества.
Все реакции делят на простые и сложные, элементарные и неэлементарные. Если одного стехиометрического уравнения достаточно, чтобы описать протекание данной реакции, то ее относят к простым реакциям, если же не достаточно – то к сложным. Сложные реакции разделяют на следующие типы:
Последовательные
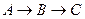
Параллельные
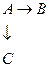
Смешанные
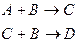
Реакции, которые рассматриваются как протекающие в одну стадию, называют элементарными; скорость их однозначно получается из стехиометрического уравнения. При отсутствии прямой связи между стехиометрическим уравнением и выражением скорости данная реакция является неэлементарной.
Молекулярность реакции – это число молекул, участвующих в элементарном акте реакции, определяющей скорость процесса. Известны моно-, би- и тримолекулырные реакции. Молекулярность относится лишь к элементарной реакции и выражается целым числом.
Скорость реакции, в которой принимают участие вещества А, В, С, … ,S можно выразить законом действующих масс
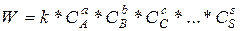 .
.
Величина n, найденная из соотношения n = а + b + с +…+s считается общим порядком реакции. Экспериментально определяемые величины а, b, с,…, s не обязательно совпадают со стехиометрическими коэффициентами уравнения реакции. Степень, в которую возводятся концентрации (a, b, c, … , s), называют порядком реакции по этому веществу.
При исследовании кинетики химической реакции рассматривают две задачи: прямую и обратную. Прямая задача заключается в отыскании кинетических кривых по известным механизмам реакций и уравнениям кинетики при заданных значениях констант скоростей реакций. Кривые, описывающие изменения концентраций веществ во времени, называются кинетическими кривыми. Обратная задача заключается в определении механизма реакции и неизвестных констант скоростей по известным экспериментальным данным (кинетическим кривым).
Методика решения прямой задачи кинетики для неэлементарных реакций.
Обозначим через Nj0 число молей компонента j до реакции, а через Nj число молей этого же компонента после реакции. Если aj – стехиометрический коэффициент при j компоненте, то величина X, определяемая из соотношения
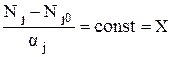 (6)
(6)
называется экстенсивной степенью полноты. Она выражает общее количество изменения и является постоянной для данной реакции.
Для реакции, протекающей при постоянном объеме V = const, мольная концентрация вещества j составляет
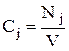 . (7)
. (7)
Тогда формула (6) записывается следующим образом:
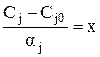 (8)
(8)
Отсюда
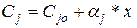 . (9)
. (9)
Величина x=X/V – интенсивная степень полноты:
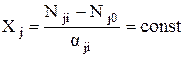 ;
;
где 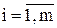 , m – число реакций.
, m – число реакций.
При V = const, разделив все члены уравнения (4.13) на объем, получаем
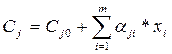 , (10)
, (10)
где 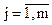 , m – число реакций.
, m – число реакций.
Дата добавления: 2015-08-01; просмотров: 1355;
