Пространственная структура белковой молекулы.
По форме молекулы и особенностям пространственной структуры белки подразделяют на глобулярные, форма молекулы которых близка к сферической или эллиптической (отношение короткой и длинной осей до 1:50), и фибриллярные, молекула которых имеет более удлиненную форму и может образовывать многомолекулярные нитевидные структуры — фибриллы.
Глобулярные белки состоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных и ковалентных связей в компактную частицу — глобулу. Эти белки, разнообразные по составу аминокислотных остатков и биологическим функциям, обычно хорошо растворимы в воде. Многие глобулярные белки являются ферментами. Почти все их полярные R-группы находятся на поверхности молекулы и гидратированы, гидрофобные R-группы находятся внутри молекулы.
Фибриллярные белки состоят из вытянутых или скрученных в спирали полипептидных цепей, расположенных параллельно и связанных многочисленными связями нековалентной и ковалентной природы. Как правило, это белки, образующие прочные жесткие структуры, они нерастворимы в воде и более однородны по составу аминокислотных остатков, преимущественно гидрофобных, в полипептидных цепях. Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул.
Первичной структурой белка называют порядок чередования (последовательность) аминокислотных остатков, соединенных ковалентными связями, в полипептидной цепи белка.
За счет внутрицепочечных взаимодействий между боковыми R-группами полипептидная цепь белка свертывается в «нативную» (природную) пространственную структуру самопроизвольно.
Для каждого белка характерна единственная трехмерная структура, обусловленная чередованием жестких полипептидных связей, одинарных связей, соотношением размеров, электрических зарядов и полярности боковых групп (R-групп аминокислот), дипольных взаимодействий и водородных связей между ними.
Все эти особенности полипептидной цепи каждого конкретного белка обусловливают формирование только одной нативной пространственной конфигурации — вторичной структуры белковой молекулы.
Вторичная структура белка — это ориентация в пространстве аминокислотных остатков, соединенных в полипептидную цепь. Различают три основных типа вторичной структуры полипептидных цепей: а-спираль, b-структура (складчатый слой) и беспорядочный клубок.
При образовании а-спирали полипептидная цепь закручивается вокруг оси. Наиболее устойчива правая а-спираль. Стабилизация спирали достигается за счет того, что витки спирали «сшиты» водородными связями между NH-группой данного остатка аминокислоты с СО-группой четвертого от него остатка. Число водородных связей максимально возможное, их направленность почти параллельна продольной оси а-спирали. На каждый виток приходится 3,6 аминокислотного остатка. Число атомов в цикле, образованном водородной связью, равно 13. Стабильность а-спирали усиливается также за счет взаимодействия направленных вниз диполей пептидных связей.
Кроме правой а-спирали известны и другие спиральные вторичные структуры полипептидных цепей, отличающиеся направленностью диполей полипептидных цепей, числом атомов в цикле от 10 до 16 и числом аминокислотных остатков на виток — от 3 до 4.4.
В b-структуре (складчатом слое) пептидные цепи располагаются параллельно друг другу, образуя пространственную фигуру, подобную складчатому листу, сложенному гармошкой. Как правило, такую структуру образуют вытянутые полипептидные цепи. Различают два типа структур: параллельную, если направление полипептидных цепей одинаково, и антипараллельную, если полипептидные цепи направлены навстречу друг другу (рис. 2).
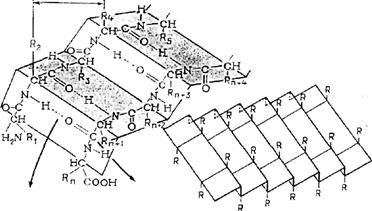
Рис. 2 Пространственная схема вторичной структуры белковой молекулы. Схема b-структуры – “складчатый лист”
Стабилизация b-структуры достигается за счет образования межцепочечных водородных связей, в которых принимают участие все пептидные связи. Все водородные связи лежат в плоскости складок b-структуры, R-группы расположены рядами выше и ниже плоскости рисунка 2. Полипептидные цепи вытянуты не полностью, поэтому образуют не плоскость, а «гофрированный» слои.
Вторичная структура белковой молекулы определяется ее первичной структурой. Поэтому, выяснив аминокислотную последовательность в полипептидной цепи, можно предсказать ее вторичную структуру, так как аминокислоты существенно различаются по способности образовывать а-спираль или b-структуру (табл. 2).
Таблица №2
Дата добавления: 2015-07-06; просмотров: 1840;
