Структура пептидной цепи белка.
В составе белковой молекулы аминокислоты образуют неразветвленную цепь, в которой они связаны ковалентными полипептидными связями:
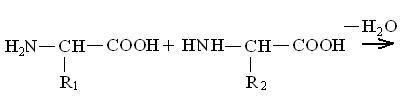
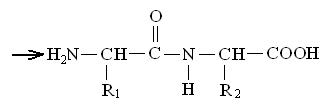
Образовавшееся соединение, являющееся результатом взаимодействия двух молекул аминокислот, называется дипептидом, а связь 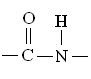 – пептидной.
– пептидной.
Свободная карбоксильная группа дипептида может соединяться с аминной группой еще одной молекулы какой-либо аминокислоты, в результате образуется трипептид. В случае соединения пептидными связями четырех остатков аминокислот получается тетрапептид, пяти — пентапептид и т.д.
Пептидная связь за счет резонанса характеризуется высокой степенью стабильности:
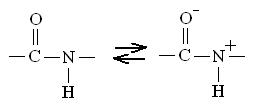
Это приводит к тому, что иминогруппа —NН— не способна принимать или отдавать протон в области рН от 0 до 14 и пептидная связь является «жесткой», исключая свободное вращение атомов вокруг нее.
Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи между —SН-группами, расположенными в полипептидной цепи цистеинов:
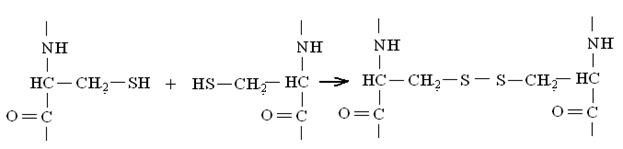
Последовательность аминокислотных остатков в полипептидной цепи с учетом дисульфидных связей составляет первичную структуру белковой молекулы, образованной связями ковалентной природы.
Все многообразие биохимических свойств природных белков обусловлено последовательностью соединения аминокислот с различными боковыми радикалами — R-группами в их полипептидной цепи.
Различие химических свойств R-групп аминокислот ведет к появлению в структуре белковой молекулы химических связей различной прочности — ионных, водородных связей и гидрофобных взаимодействий.
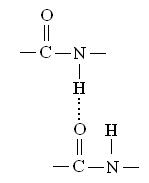
Водородные связи возникают в результате дипольных взаимодействий между положительно заряженным ковалентно связанным водородным атомом и отрицательно заряженным ковалентно связанным атомом — акцептором. Ниже приведены примеры различных водородных связей {обозначены пунктиром), образующихся в белках. Водородная связь между пептидными группами:
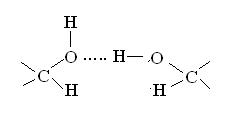
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:

Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:
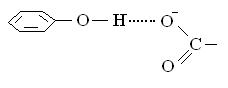
Соединение полипептидов может возникать, как уже указывалось выше, и за счет сульфгидрильных группировок цистеина с образованием дисульфидной ковалентной связи.
Такие кислоты, как лизин и аспарагиновая, могут образовывать солевые или ионные связи:
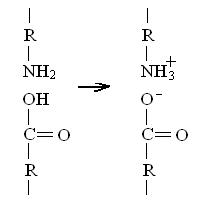
Кроме ковалентных, ионных, водородных связей в молекуле белка возникают гидрофобные взаимодействия или связи.
Если ионные и водородные связи возникают в результате дипольных взаимодействий, полярных атомов или заряженных групп двух или более полярных молекул, то гидрофобные взаимодействия связывают неполярные (гидрофобные) части одной или нескольких молекул в водных растворах. Энергия каждого такого взаимодействия мала, но из-за большого числа таких взаимодействий они способны создавать устойчивые структуры. Под влиянием гидрофобных взаимодействий происходит сближение неполярных участков полипептидной цепи за счет вытеснения молекул воды и ослабления их взаимодействия с водной средой.
Способностью к гидрофобному взаимодействию обладают боковые цепи (R-группы) валина, лейцина, изолейцина, фенилаланина, пролина, триптофана, метионина и цистеина.
Ионные, водородные связи и гидрофобные взаимодействия определяют и стабилизируют специфическую пространственную структуру молекулы каждого белка.
Дата добавления: 2015-07-06; просмотров: 2075;
