Свойства аминокислот.
Физические свойства. Аминокислоты представляют собой бесцветные кристаллические вещества. Большинство из них легко растворяются в воде и 80%-ном этаноле. Многие а-аминокислоты обладают сладким вкусом, иногда с некоторым неприятным привкусом.
Оптические свойства. Стереоспецифичность, свойственная многим биомолекулам, — это характерная особенность молекулярной логики живых клеток, которая подтверждает, что трехмерная структура биомолекул имеет чрезвычайно важное значение для их биологических функций. Аминокислоты являются оптически активными соединениями, за исключением глицина. Это объясняется наличием в а- положении асимметрического или хирального атома углерода.
Формы L и D относятся к абсолютной конфигурации аминокислот. Принадлежность к L- или .D-ряду определяется взаимным расположением аминной и карбоксильной групп и радикала аминокислот. К L-ряду относят те аминокислоты, у которых атом водорода, карбоксильная и аминная группы находятся по отношению друг к другу по часовой стрелке. К D-ряду относят те аминокислоты, у которых атом водорода, карбоксильная и аминная группы находятся против часовой стрелки:
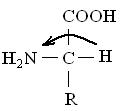
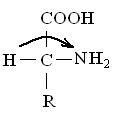
L-ряд D-ряд
Все встречающиеся в растительных белках аминокислоты принадлежат к L-ряду. D-формы аминокислот не усваиваются организмом человека и животных и часто являются ингибиторами ферментативных реакций. D-формы аминокислот встречаются у некоторых антибиотиков. Синтетические аминокислоты являются рацематами, т. е. смесью, состоящей из 50 % L-аминокислот и 50 % D-аминокислот.
Молекулы, имеющие асимметрический атом углерода, способны вращать плоскость поляризованного луча вправо. В этом случае их обозначаютзнаком (+) или влево — знаком (—). Принадлежность к L- или D-ряду может не совпадать с направлением отклонения плоскости поляризованного луча. Поэтому различают L (+) — аминокислоты, относящиеся к L-ряду и вращающие плоскость поляризации вправо: L (—) — аминокислоты L-ряда и отклоняющие луч поляризованного света влево. По аналогии имеются аминокислоты D (+)- и D (—)-рядов. Направление отклонения поляризованного луча зависит от природы растворителя, рН среды и других факторов.
Ароматические аминокислоты поглощают ультрафиолетовые лучи—триптофан и тирозин — при 280 нм, фенилаланин — при 260 нм. Молекулы аминокислот имеют высокие дипольные моменты, а их растворы — высокую диэлектрическую проницаемость.
Изоэлектрическая точка. Аминокислоты представляют собой биполярные ионы (внутренние соли). Под действием электрического тока они мигрируют к катоду или аноду (в зависимости от рН среды). Значение рН среды, при которой устанавливается равенство положительных и отрицательных зарядов, называется изоэлектрической точкой.
В изоэлектрической точке аминокислоты электрически нейтральны. Превращения аминокислот в водной среде можно проиллюстрировать следующими схемами.
Изоэлектрическая точка:

Биполярный ион, аминокислота не мигрирует ни к катоду, ни к аноду.
Кислая среда (рН ниже, чем в изоэлектрической точке):
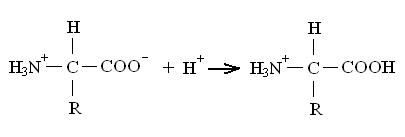
Вследствие наличия недиссоциированной карбоксильной группы аминокислота ведет себя, как катион, — мигрирует к катоду.
Щелочная среда (рН выше, чем в изоэлектрической точке):
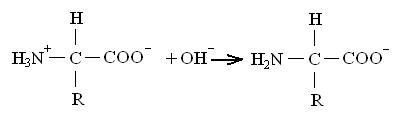
Вследствие наличия заряженной карбоксильной группы аминокислота ведет себя, как анион, — мигрирует к аноду.
Взаимодействие с азотистой кислотой.
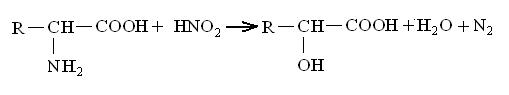
Аминокислота Оксикислота
Эту реакцию используют для определения аминокислот по количеству выделившегося газообразного азота (метод Ван — Сляйка).
Взаимодействие с формальдегидом. Реакция идет в щелочной среде:
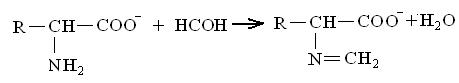
Образующееся алкилдиеновое производное обладает кислотными свойствами и легко оттитровывается щелочью. Реакция используется для определения аминокислот (по количеству пошедшей на титрование щелочи). Метод получил название метода формольного титрования, или метода Сёренсена.
Таблица №1
Дата добавления: 2015-07-06; просмотров: 1714;
