Строение глиадинов и глютенинов. Клейковина.
Из белков злаковых выделены глиадины. Они характеризуются значительным полиморфизмом, выявлено 17—25 глиадиновых компонентов в зависимости от сорта пшеницы, а в целом —43 компонента. Некоторые авторы, исходя из различной подвижности в электрическом поле, выделяют 4 группы глиадинов: a, b, g и w. Их аминокислотный состав установлен. Характерно очень высокое содержание глутаминовой кислоты и пролина. Данные a, b и g -глиадины имеют сходство, а w-глиадины отличаются от последних.
Глиадины — белки с малым зарядом. Они содержат лишь 6—11 основных остатков на молекулу (лизин, гистидин, аргинин). Приблизительно 85—95 % остатков Глу и Асп находятся в форме амидов. На молекулу приходится 8—9 свободных карбоксильных групп. Большое содержание пролина оказывает влияние на вторичную структуру. Повышенное содержание неполярных остатков создает возможность неглобулярной конформации.
Питательная ценность глиадинов пшеницы ограничена из-за малого содержания в них лизина и достаточно высокой влажности пшеницы. Относительная молекулярная масса фракций (по разным данным): для a —22 000-60000; b - 27 000-41 000; g — 16 000-44 000; w - 57 000-80 500.
До сих пор еще не установлена полная аминокислотная последовательность ни для одного из глиадинов. Известны последовательности N-концевых половин цепей. Анализ показывает существование повторяющихся последовательностей у всех глиадинов, которые начинаются приблизительно после 12 аминокислотных остатков N-конца. Эти последовательности неидентичны, но близки и обычно включают три глутамина и один пролин. Ни в одном белке не выявлена связь пролин—пролин. Соотношение полярных и неполярных остатков в N-концевых последовательностях для a- и b-типов около 50 %.
pI белков для фракций находится в широком диапазоне рН (5— 9). Гидрофобность (суммарная) определена по аминокислотному составу, измерению растворимости, хроматографией, по способности связывать гидрофобные лиганды. Доказано существование гидрофобных доступных зон у всех глиадинов, а также выявлены различия между глиадинами в гидрофобности поверхности. w-белки имеют самую малую гидрофобность, а g-белки —самую высокую. Гидрофобность a- и b-фракций изменчива и зависит от рассматриваемых компонентов, продемонстрирована при изучении растворимости белков клейковины в нейтральных солевых растворах.
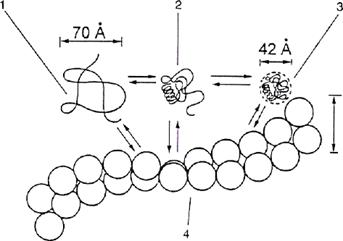
Все a-, b-, g- и w-глиадины состоят из одной полипептидной цепи. Цистеины в молекулах a-, b-, g-глиадинов связаны внутримолекулярными дисульфидными мостиками. Их разрыв приводит к значительной фрагментации цепи. В твердом состоянии эти белки имеют компактную структуру. При высокой концентрации в растворах они стремятся к агрегированию, видимо, вследствие образования водородных связей. В денатурирующей среде белки имеют рыхлую асимметричную структуру. Восстановление дисульфидных мостиков усиливает асимметрию (рис. 3).
Структура некоторых глиадинов, называемых А-глиадинами, изучена наиболее полно. Их четвертичная структура очень широко изменяется в зависимости от условий среды (рН и ионной силы). Их агрегация происходит при рН > 5 и m > 0,005. Агрегация обратима и поэтому обусловлена нековалентными связями, скорее всего водородными. В агрегированном состоянии они находятся в виде фибрилл с d = 600 нм. Этот диаметр больше диаметра линейной ассоциации жестких клубков и меньше диаметра ассоциации статических клубков (700 нм). Эти микрофибриллы в концентрированном растворе могут образовывать устойчивую трехмерную сеть.
|
Рис. 3. Изменение структуры и состояния анрегирования А-глиадина
под влиянием условий среды (рН, ионная сила, денатурирующий агент):
1 – статический клубок (мочевина, 8М раствор); 2 – частично развернутая структура (разбавленная кислота); 3 – компактная структура (рН > 5, ионная сила около нуля); 4 – фибриллярные агрегаты (рН > 5, ионная сила > 0,005)
Глютениновая фракция также гетерогенна (всего до 20 фракций). Их относительная молекулярная масса от 100 000 до нескольких миллионов. Глютенины несколько изменяют свой аминокислотный состав в зависимости от способа выделения, особенно по лизину. Они отличаются от глиадинов: содержат явно больше лизина, глицина, аланина, серина и тирозина, но меньше глутаминовой кислоты, пролина и цистеина.
Белковые комплексы состоят из очень разнородных фракций и субъединиц. Некоторые из них близки к альбуминам и глобулинам, другие — к глиадинам. Третья группа характеризуется более специфическим аминокислотным составом среди белков пшеницы, похожих на коллаген, рI этих белков отмечается при рН 6—8. Полная аминокислотная последовательность ни одной из субъединиц высокомолекулярных глютенинов и глиадинов неизвестна. N-концевые участки чаще всего богаты глутаминовой или аспарагиновой кислотой.
Растворимость глютенинов в растворах детергентов или мылах указывает на то, что гидрофобные взаимодействия играют важную роль в структуре и агрегации глютенинов, что предполагает значительную долю гидрофобной поверхности субъединиц. По этому показателю выделяют две группы субъединиц: с относительной молекулярной массой свыше 50 000 и малой поверхностью гидрофобности (2930—35 590 Дж/остаток); с относительной молекулярной массой менее 50 000 и значениями поверхности гидрофобности, близкими к глиадинам (4060—4230 Дж/остаток).
По структуре различают два уровня организации глютенинов: субъединицы и образованный ими комплекс (нативный или функциональный).
Вторичные и третичные структуры субъединиц изучены слабо. Предполагается низкая степень спирализации в растворе, конформация менее компактна, чем у глиадинов. Из-за высокого содержания глицина субъединицы гибкие. Они состоят из последовательности складчатых, слабо оформившихся структур и коротких спиральных последовательностей. Структура глютенинов полностью не выяснена, но установлена роль дисульфидных мостиков в ее организации.
В настоящее время предложены три основные модели (Эварта, Казарда и Бушука), которые уточняют принятую модель трехмерной ковалентной сети, образованной смесью белковых субъединиц, связанных между собой дисульфидными мостиками. Они формируют супермолекулу с молекулярной массой в несколько миллионов дальтон. Многочисленные исследования показали нерастворимость или частичную растворимость глютенинов в отсутствие восстанавливающих агентов, а также высвобождение белковых субъединиц и уменьшение вязкости после разрыва дисульфидных мостиков.
Согласно модели Эварта (рис. 4) молекула глютенина может быть образована ассоциацией (конкатенацией) нескольких субъединиц линейной формы. Субъединицы связаны между собой через первый межмолекулярный дисульфидный мостик и второй внутримолекулярный.
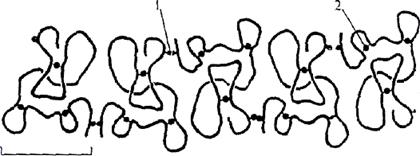
Субъединица
глютенина
Рис. 4. Линейная модель глютенина (конкатенация) по
Гринвуду и Эварту в модификации Эварта:
1,2—соответственно межмолекулярный и внутримолекулярный дисульфиные мостики
В результате конкатенации молекула глютенина в нативном состоянии может иметь свернутую и компактную конформацию и удлиняться под влиянием внешних воздействий. После их устранения может последовать фаза релаксации полипептидной цепи, которая возвращает ее к компактной нативной форме, более благоприятной с точки зрения термодинамики, что свидетельствует об эластичности глютенинов. Если растягивающие силы воздействия сохраняются достаточно долго, составные цепочки могут приобрести новые ориентации и конформации, столь же устойчивые, как и их первоначальная конформация, за счет скольжения молекул одна относительно другой. Этим объясняется вязкое истечение системы без вовлечения механизмов обмена между дисульфидными мостиками и свободными сульфгидрилами.
Модель Казарда отличается тем, что в ней между субъединицами существуют ковалентные связи, а их ассоциации образованы только за счет вторичных связей.
В модели Бушука предполагается наличие как дисульфидных мостиков, так и слабых связей в структуре функционального глютенина для обеспечения солюбилизации глютенина в диссоциирующих агентах и мылах, а также для движения субъединиц под действием электрического тока.
Согласно модели Бушука различают два типа глютенинов.
I тип образован субъединицами с относительной молекулярной массой менее 68 000, преимущественно 44 000. Глютенины соединяются в функциональный глютенин с помощью нековалентных связей. Они легко переходят в раствор при помощи разбавленной уксусной кислоты и диссоциирующих агентов.
II тип состоит из субъединиц с относительной молекулярной массой более 68 000. Связь между пептидами ковалентна и содержит по меньшей мере один межмолекулярный дисулъфидный мостик. Пептиды способны мигрировать в процессе электрофореза в присутствии DDC—Na (додецилсульфат Na) после восстановления дисульфидных мостиков вследствие очень высокой молекулярной массы ассоциаций. Последние могут формировать агрегаты посредством гидрофобного взаимодействия. Белки I типа прочно соединяются с белками II типа или захватываются последними, ибо фракция этого типа высвобождается после восстановления дисульфидных мостиков. Размер белков II типа изменчив, а их конформация более или менее компактна в зависимости от числа межмолекулярных дисульфидных мостиков и их расположения. Глютенины I и II типов соединяются между собой нековалентными, вероятно, гидрофобными взаимодействиями. Глютенины II типа обеспечивают эластичность функционального глютенина посредством механизма, аналогичного механизму конкатенации Эварта, и вязкость за счет подвижности молекул глютенинов II типа относительно друг друга. Высокоэластичные свойства в итоге очень сильно зависят от соотношения соответствующих концентраций глютенинов I и II типов и от силы их взаимодействий. Таким образом, модель Бушука более полная, завершенная в том отношении, что вовлекает низкомолекулярные глютенины. Кроме того, она хорошо согласуется с известными биохимическими и реологическими свойствами глютенинов.
В ультраструктуре зерна злаковых, установленной с помощью электронной микроскопии, обнаружены фибриллы, ламеллы и глобулярные агрегаты.
Клейковина представляет собой белковый комплекс, который можно выделить с помощью большого количества воды из теста, приготовленного из пшеничной муки. В результате отмывания получают вязкоэластичную нерастворимую массу, которая в сухом виде составляет примерно 10 % исходного количества муки и имеет высокую водоудерживающую способность (около 150%). Клейковину получают различными способами. Ниже приведена одна из известных схем получения клейковины из пшеницы (рис. 5).
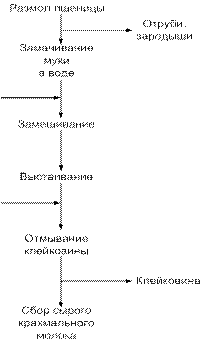
Рис. 5. Схема получения клейковины из пшеницы
Клейковина содержит 75-80 % белков, 5-10 % липидов и остаточный крахмал, количество которого зависит от эффективности к длительности отмывания. Липиды играют функциональную роль и связаны с белками клейковины. В нее входят два основных белковых компонента: глиадинъг и глютенины в разных соотношениях (40—50 % для каждой группы), а остальное количество представлено остаточными растворимыми белками, большая часть которых удаляется при отмывании.
Физико-химические свойства и реология клейковины зависят от свойств входящих в нее компонентов. Существует несколько гипотез структуры клейковины.
Гидратироваиная клейковина имеет структуру листа липопротеидного типа, образованного вокруг молекулярного слоя фосфолипидов. Боковые неполярные цепи полипептидов составляют гидрофобные ядра. Полярные группы, ориентированные наружу, образуют с фосфолипидами солевые связи между основными группами белков и кислыми группами липидов. Ориентированный бимолекулярный липидный слой создает плоскость скольжения между двумя слоями листка, обеспечивая тем самым вязкую текучесть. При этом глютенины играют определенную роль в структуре клейковины благодаря их свойствам агрегирования и способности к образованию волокон и ламелл, как установлено при исследовании ультраструктуры.
Когезия и упругость клейковины предопределяются склонностью различных белков к взаимному соединению. Глютенины, крупные асимметричные молекулы, образуют очень большую доступную поверхность, что способствует формированию многочисленных нековалентных связей между молекулами глютенинов, а также с глиадинами. В сильной степени агрегированные глютенины обеспечивают прочность, устойчивость клейковины, тогда как слабосцепленные глиадины облегчают изменение формы. В клейковине различают 6 типов полипептидов: высокомолекулярные, близкие к глютенинам (относительная молекулярная масса 8000— 133000); агрегированные полипептиды, близкие по аминокислотному составу к альбуминам и глобулинам (относительная молекулярная масса 20000—70000); высокомолекулярные глиадины, состоящие из субъединиц с относительной молекулярной массой 44000 и 36 000; низкомолекулярные глиадины (a-,b-,g- и w-глиадины, альбумины и глобулины).
Вторая гипотеза, построенная на основе микроскопических исследований явлений, сопровождающих гидратацию частиц муки, предполагает, что белковые волокна появляются мгновенно. Они имеют вязкоэластичные свойства, что присуще клейковине, полученной механическим путем. В нативном состоянии белки пшеницы обладают, таким образом, специфическими свойствами, которые придают им вязкость и упругость. Диаметр изолированных фибрилл обычно составляет 500—1000 нм. Соединяясь путем навивки, они дают более крупные фибриллы диаметром 5000— 10000 нм.
Структура гидратированной клейковины аналогична структуре фибрилл А-глиадинов, определенные реологические свойства которых в концентрированном растворе близки к свойствам клейковины. Слабые деформации обратимы за счет возврата взаимодействий к их минимальному энергетическому уровню. После существенных деформаций возможно прогрессивное и последовательное преобразование первоначальных связей между фибриллами (упругость).
Нековалентные связи между волокнами позволяют им перемещаться относительно друг друга под действием значительных ограничений и сил (вязкость). В этой схеме функциональная единица является не полипептидной цепью, а белковой фибриллой. В зависимости от характера фибрилл их способность к взаимодействию может варьировать. Например, изменение теста, подвергаемого механическим воздействиям, обусловлено перекомбинацией фибрилл со слабой или сильной способностью взаимодействия. Участие липидов здесь необязательно.
Предложенные модели не исключают друг друга полностью, в каждой из них придается большое значение межмолекулярным дисульфидным и нековалентным связям.
Дата добавления: 2015-07-06; просмотров: 2863;
