ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Химические реакции можно разделить на два типа. К первому относятся реакции, которые идут без изменения степени окисления атомов реагирующих веществ. В таких реакциях взаимодействие электронных оболочек у реагирующих частиц сводится к образованию общих молекулярных орбиталей. Все электроны остаются общей принадлежностью этих частиц, между которыми возникает ковалентная связь.
Ко второму типу относятся реакции, которые протекают с изменением степени окисления атомов реагирующих веществ. В таких реакциях столкновение частиц сопровождается переходом электронов от одного из реагентов к другому. Эти реакции получили название «ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ». В отечественной литературе часто используется сокращение ОВР, а в иностранной REDOX от латинских восстановление-окисление. Окислительно-восстановительная реакция – это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление – это процесс потери электронов атомом, молекулой или ионом.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом.
Частица, отдающая свои электроны, в ходе реакции окислятся. Ее принято называть ВОССТАНОВИТЕЛЕМ (обозначим ее как ВОС):
ВОС - n 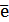 → продукт окисления (окисленная форма).
→ продукт окисления (окисленная форма).
Частица, которая эти электроны присоединяет, в ходе реакции восстанавливается. Ее принято называть ОКИСЛИТЕЛЕМ (обозначим ее как ОК):
ОК + n 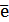 → продукт восстановления (восстановленная форма).
→ продукт восстановления (восстановленная форма).
Например, в реакции 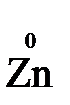 +
+ 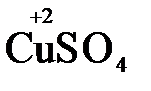 →
→ 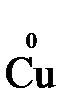 +
+ 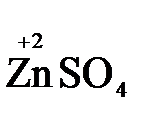
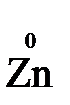 - 2
- 2 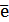 →
→ 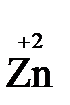 (полуреакция окисления)
(полуреакция окисления)
Восстановитель окисленная форма
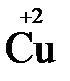 +2
+2 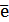 = →
= → 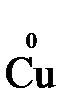 (полуреакция восстановления)
(полуреакция восстановления)
Окислитель восстановленная форма
Окислительно-восстановительные реакции очень широко распространены в природе. К ним относятся реакции фотосинтеза у растений, дыхание живых организмов, процессы горения и коррозии металлов и многие другие.
Дата добавления: 2015-07-24; просмотров: 595;
