ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества , содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F2, O2, Cl2, S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO4-);
3) перекисные соединения.
Конкретными веществами, применяемыми на практике в качестве окислителей, являются кислород и озон, хлор, бром, перманганаты, дихроматы, кислородные кислоты хлора и их соли (например, 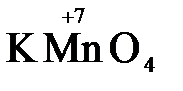 ,
, 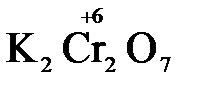 ,
, 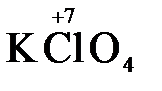 ), азотная кислота (
), азотная кислота ( 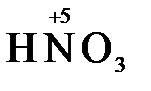 ), концентрированная серная кислота (
), концентрированная серная кислота ( 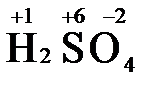 ), диоксид марганца (
), диоксид марганца ( 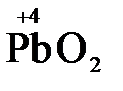 ), пероксид водорода и пероксиды металлов (
), пероксид водорода и пероксиды металлов ( 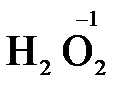 ,
, 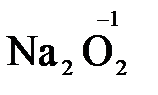 ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe2+);
3) простые элементарные анионы, например, сульфид-ион S2-;
4) кислородосодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит 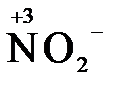 , сульфит
, сульфит 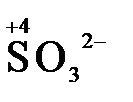 ).
).
Конкретными веществами, применяемыми на практике в качестве восстановителей, являются, например, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогенводороды (кроме HF), органические вещества – спирты, альдегиды, формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, моноксид углерода ( 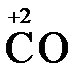 ) и алюминий при высоких температурах.
) и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO2- в кислой среде выступает в роли окислителя по отношению к иону I-:
2 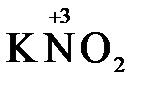 + 2
+ 2 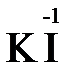 + 4 HCl→
+ 4 HCl→ 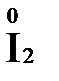 + 2
+ 2 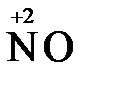 + 4KCl + 2H2O
+ 4KCl + 2H2O
и в роли восстановителя по отношению к перманганат-иону MnO4-
5 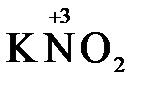 + 2
+ 2 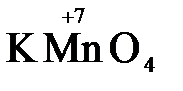 + 3H2SO4 → 2
+ 3H2SO4 → 2 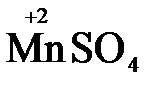 + 5
+ 5 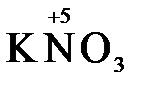 + K2SO4 + 3H2O
+ K2SO4 + 3H2O
Дата добавления: 2015-07-24; просмотров: 2232;
