ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА ВЕЛИЧИНУ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА
Величина окислительно-восстановительного потенциала (ОВ-потенциала) зависит от химической природы материала электрода, температуры, концентрации и природы потенциалопределяющих частиц в растворе. Эта зависимость выражается уравнением Нернста:
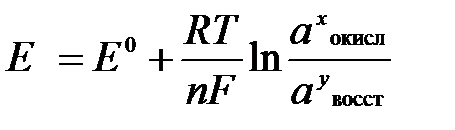 (2)
(2)
В этом уравнении Е – электродный потенциал (В); Е0- стандартный электродный потенциал (В); R = 8,31 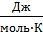 универсальная газовая постоянная; Т-температура (К); n – число моль электронов в полуреакции; F–число Фарадея; aокисл-активность окисленной формы потенциалопределяющих частиц (моль/л); aвосст – активность восстановленной формы потенциалопределяющих частиц (моль/л).
универсальная газовая постоянная; Т-температура (К); n – число моль электронов в полуреакции; F–число Фарадея; aокисл-активность окисленной формы потенциалопределяющих частиц (моль/л); aвосст – активность восстановленной формы потенциалопределяющих частиц (моль/л).
Введем несколько упрощений:
1) при стандартной температуре 298К и переходе к десятичным логарифмам, получим 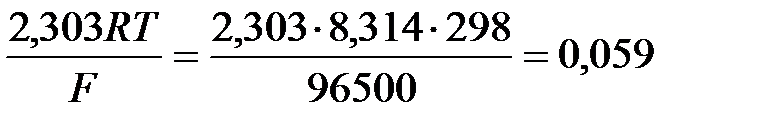 В;
В;
2) для разбавленных растворов активности с достаточным приближением могут быть заменены концентрациями (aокисл=[окисл], aвосст =[восст]). В результате для стандартной температуры уравнение принимает следующий вид:
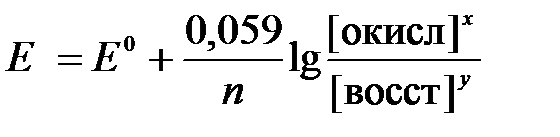 (3)
(3)
где «х» и «y» коэффициенты перед окисленной и восстановленной формой потенциалопределяющих частиц в ОВ-полуреакции.
Например, для полуреакции окисления ионов Mn2+
Mn2++4H2O - 5 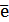 = MnO4- + 8H+,
= MnO4- + 8H+,
в которой слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, уравнение Нернста для стандартной температуры будет иметь следующий вид:
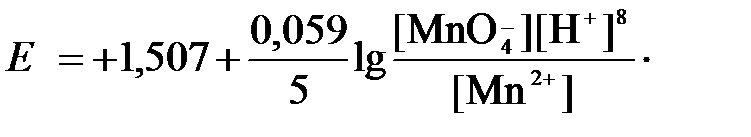
Подлогарифмическое выражение является константой равновесия реакции:
 , поэтому уравнение (3) может быть представлено в
, поэтому уравнение (3) может быть представлено в
следующем виде:
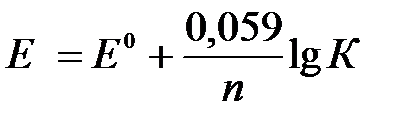 . (4)
. (4)
Если электродная система состоит из металлического электрода, опущенного в раствор, содержащий одноименные ионы Me0 - n 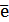 = Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид:
= Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид: 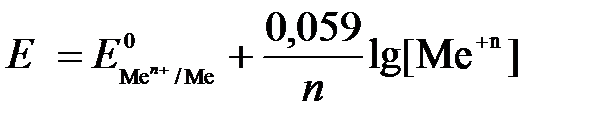 (5)
(5)
Для окислительно-восстановительных реакций исходя из соотношения ΔG0х.р = -nFΔЕ иlnK =- ΔG0х.р /RT можно вычислить значения константы равновесия:
lnК= 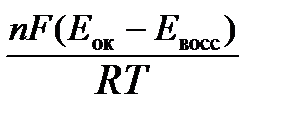 (6)
(6)
Еок – потенциал окислителя, Евосс- потенциал восстановителя.
Для стандартной температуры и десятичных логарифмов:
lgК= 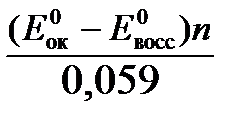 . (7)
. (7)
Дата добавления: 2015-07-24; просмотров: 1215;
