СТЕПЕНЬ ОКИСЛЕНИЯ
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от реально существующих зарядов у ионов, степень окисления показывает лишь условный заряд атома в молекуле. Она может быть отрицательной, положительной и нулевой. Например, степень окисления атомов в простых веществах равна «0» ( 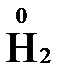 ,
, 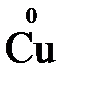 ,
, 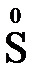 ,
, 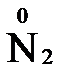 ). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).
). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной кислоты H2SO4 атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы -  . Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 (
. Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 ( 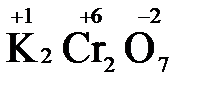 ).
).
Дата добавления: 2015-07-24; просмотров: 1220;
