Влияние степени окисления и радиуса иона на силу кислот и оснований
Чтобы установить от каких факторов зависит характер диссоциации вещества и выяснить, почему, например, Са(ОН)2 является основанием, а сходное по формуле соединение В(ОН)3 – кислотой необходимо рассмотреть упрощенную структуру, предложенную Косселем. Она отображает группировку атомов Э-О-Н, где Э - химический элемент.
 |
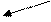
 H+
H+
●
Эn+ O 2-
Размеры катиона и аниона представлены в виде сфер, радиусы которых соответствуют радиусам ионов. Их взаимодействие определяется электростатическим притяжением.
Радиус иона водорода (протона) ничтожно мал и поэтому принимается расстояние между ионом водорода и центром иона кислорода, равным радиусу иона кислорода. Направление диссоциации соединения, содержащего группировку Э-О-Н, зависит от прочности связей Э-О и О-Н. Если прочнее связь Э-О, то разрывается связь О-Н с образованием иона Н+ и соединение выступает в роли кислоты. Наоборот, если прочнее связь О-Н, то при диссоциации разрывается связь Э-О и отщепляется ион ОН-, и вещество ведет себя как основание. Если связи Э-О и О-Н по прочности примерно одинаковы, то мы имеем амфотерное соединение.
По схеме Косселя, связь Э-О тем прочнее, чем больше заряд и меньше радиус катиона. С другой стороны, увеличение положительного заряда и уменьшение радиуса элемента приводит к понижению энергии связи О-Н в соединении Э-О-Н, так как в этом случае протон сильнее отталкивается от центрального катиона. Это приводит к тому, что соединение все в большей степени проявляет кислотные свойства. Так, в ряду хлоркислородных кислот с увеличением степени окисления хлора увеличивается сила кислот и уменьшается их окислительная способность, так как связь С1-О становится прочнее.
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
Хлорноватистая кислота является наиболее сильным окислителем за счет атомарного кислорода, легко отщепляющегося в водных растворах HClO = HCl + O.
d – Металлы в низшей степени окисления образуют соединения, которые проявляют основные свойства; в высшей степени окисления - кислотные, а с промежуточной степенью окисления - амфотерные (табл.3).
Из данных таблицы следует, что рост положительного заряда и уменьшение радиуса центрального иона в кислородсодержащих кислотах приводит к росту прочности связи О - Э и уменьшению прочности связи Н – О, что сопровождается усилением кислотных свойств соединения.
Таблица 3
Дата добавления: 2015-07-22; просмотров: 1801;
