Равновесие в системе, содержащей раствор и кристаллы растворителя
Рассмотрим бинарные системы, в которых вещества неограниченно растворимы друг в друге в жидком состоянии и совершенно нерастворимы в твердом.
По-прежнему будем обозначать величины, относящиеся к растворителю, индексом 1, а величины, относящиеся к растворенному веществу, индексом 2.
Если взять жидкий раствор такого типа, то при охлаждении его до определенной температуры начнут выделяться первые кристаллики твердого чистого вещества. Этим веществом является растворитель. Если между первым кристалликом твердого растворителя и раствором устанавливается равновесие, то для его описания используется равенство химических потенциалов
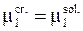 .
.
Химический потенциал вещества в кристаллике 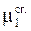 соответствует состоянию чистого твердого кристаллического вещества. Его можно обозначить также
соответствует состоянию чистого твердого кристаллического вещества. Его можно обозначить также 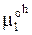 . Химический потенциал вещества в растворе m1sol зависит от его активности:
. Химический потенциал вещества в растворе m1sol зависит от его активности:
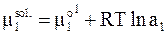 .
.
Из равенства химического потенциала в равновесно сосуществующих фазах следует
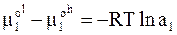 . (8 - 17)
. (8 - 17)
Химические потенциалы чистого вещества, входящие в левую часть уравнения (8 - 17), равны значениям энергии Гиббса в этих состояниях (для чистого вещества парциальная молярная величина и просто молярная величина совпадают). Поэтому левая часть уравнения (8 - 17) представляет собой изменение энергии Гиббса при переходе одного моля вещества из твердого состояния в жидкое при температуре кристаллизации раствора. Необходимо отметить, что для плавления чистого растворителя при нормальной температуре кристаллизации изменение энергии Гиббса должно быть равно нулю. В данном случае переход из твердого в жидкое состояние происходит ниже нормальной температуры кристаллизации, и приращение энергии Гиббса при плавлении равно не нулю, а оказывается равным
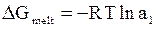 . (8 - 18)
. (8 - 18)
Используя уравнение Гиббса - Гельмгольца для данного процесса, получим
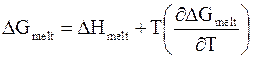 ; (8 - 19)
; (8 - 19)
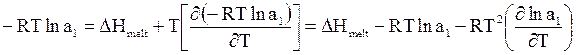
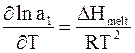 . (8 - 20)
. (8 - 20)
Для достаточно узкого диапазона температур теплоту плавления DHmelt можно считать постоянной. В связи с этим интегрирование уравнения (8 - 20) при условии, что стандартной активности растворителя (a1=1) отвечает стандартная теплота плавления То, дает
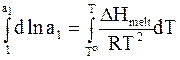 ;
;
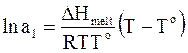 . (8 - 21)
. (8 - 21)
Обозначив понижение температуры замерзания раствора по отношению к чистому растворителю DТ и приняв, что температуры Т и То достаточно близки, чтобы заменить произведение ТТо на То2, получим
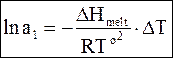 . (8 - 22)
. (8 - 22)
Уравнение (8 - 22) позволяет рассчитать термодинамическую активность растворителя по понижению температуры замерзания раствора.
Для разбавленных растворов можно принять
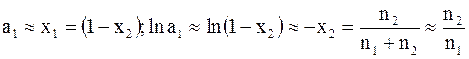 ;
;
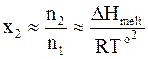 . (8 - 23)
. (8 - 23)
Если масса растворителя равна 1000 г, то его количество составляет 1000/M1 моль. Этому условию отвечает моляльность растворенного вещества m2.
Не приводя выкладки, подобные использованным в предыдущем параграфе, запишем окончательную форму уравнения
 . (8 - 24)
. (8 - 24)
Зависимость между понижением температуры замерзания и содержанием в растворе растворителя также впервые установил Ф. Рауль.
Константа, входящая в уравнение (8 - 24), равна
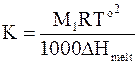 . (8 - 25)
. (8 - 25)
Уравнения (8 - 21) и (8 - 24) используются для нахождения термодинамической активности растворителя и моляльности раствора по температуре его замерзания. Этот метод изучения растворов получил название криометрииили криоскопии. Константа К называется криоскопической постоянной.
Уравнение (8 - 24) используется для определения молярных масс веществ по методу криометрии. Для обеспечения достаточной точности определений криоскопическая постоянная растворителя должна быть по возможности большой. Этому условию в наибольшей степени удовлетворяет криоскопическая постоянная камфоры, которая превышает криоскопическую постоянную воды, равную 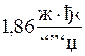 , в 21 раз.
, в 21 раз.
Дата добавления: 2015-07-24; просмотров: 883;
