Равновесия в системе жидкость - жидкость
Рассмотрим два случая равновесия в системе жидкость - жидкость.
Первый из них относится к смеси двух чистых жидкостей А и В, ограниченно растворимых друг в друге. При их смешении образуются два слоя, один из которых представляет собой раствор вещества В в жидкости А, а другой - раствор вещества А в жидкости В. Если с повышением температуры растворимость жидкостей друг в друге повышается, то наступает такая температура, при которой образуется гомогенная смесь. Она называется верхней критической температурой. Растворимость жидкостей друг в друге может также возрастать при понижении температуры, что приводит к появлению гомогенной смеси при нижней критической температуре. Возможно одновременное существование для системы верхней и нижней критических температур (система никотин - вода).
Особый интерес представляют системы жидкость - жидкость с растворенным в каждой из них веществом i. Ранее неоднократно отмечалось, что условием равновесного распределения вещества между двумя фазами является равенство химических потенциалов, т.е.
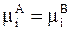 ,
,
из чего следует
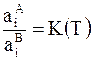 ,
,
где К(Т) - константа распределениявещества между фазами.
Для разбавленных растворов активности можно заменить концентрациями. В этом случае их отношение описывается выражением:
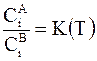 .
.
Если вещество i в жидкостях состоит из разного числа первичных частиц (молекул), то переход его из одной жидкости в другую можно представить как своеобразную реакцию
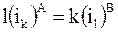 , (8 - 26)
, (8 - 26)
для которой условие равновесия принимает вид
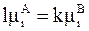 . (8 - 27)
. (8 - 27)
В уравнениях (8 - 26) и (8 - 27) k и l означают числа ассоциации, которые показывают, какое число первичных частиц содержит частица, присутствующая в данной жидкости. Например, в воде уксусная кислота состоит из одинарных молекулярных частиц, а в бензоле - из сдвоенных (СН3СООН)2, и число ассоциаций для воды равно 1, а для бензола равно 2.
Приняв 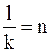 , с приведенными выше приближениями получим общее уравнение распределения вещества между двумя фазами
, с приведенными выше приближениями получим общее уравнение распределения вещества между двумя фазами
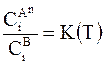 . (8 - 28)
. (8 - 28)
Уравнение (8 - 28) называется также уравнением Нернста - Шилова . Оно лежит в основе процесса экстракции - концентрирования веществ при переходе их из одной жидкости в другую.
Дата добавления: 2015-07-24; просмотров: 1168;
