Способы определения величины осмотического давления
Существуют разнообразные способы прямого определения осмотического давления. По одному из них между чистым растворителем и раствором помещают полупроницаемую мембрану и находят разность уровней жидкостей, при которой прекращается осмос. По другому к раствору, отделенному от чистого растворителя полупроницаемой мембраной, прилагают такое давление, при котором прекращается всасывание растворителя раствором.
Методы, основанные на применении полупроницаемых мембран, требуют длительного времени, так как равновесие устанавливается медленно, и трудоемки. В связи с этим их заменяют методами, основанными на коллигативных свойствах растворов.
Сравнивая уравнения (9 - 3), (9 - 4), (9 - 5) и (9 - 15), нетрудно убедиться в том, что осмотическое давление, как коллигативное свойство растворов, можно вычислять, используя данные для других коллигативных свойств: понижение температуры замерзания, повышение температуры кипения и понижение давления пара над раствором по сравнению с чистым растворителем.
Подставив в уравнение (9 - 13) вместо логарифма активности растворителя правую часть уравнения (8 - 22), получим
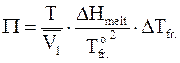 . (9 - 16)
. (9 - 16)
Уравнение (9 - 16), устанавливающее зависимость между осмотическим давлением и понижением температуры замерзания раствора DTfr. (DHmelt - изменение энтальпии при плавлении растворителя, 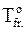 - нормальная температура замерзания растворителя), наиболее широко используется для определения осмотического давления.
- нормальная температура замерзания растворителя), наиболее широко используется для определения осмотического давления.
Приведем уравнения для вычисления осмотического давления по повышению температуры кипения растворов и по понижению давления пара над раствором:
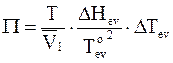 ; (9 - 17)
; (9 - 17)
 . (9 - 18)
. (9 - 18)
Уравнение (9 - 17) получается сочетанием уравнений (9 - 13) и (8 - 12), а уравнение (9 - 18) - уравнений (9 - 14) и (9 - 3).
Входящее в уравнение (9 - 17) повышение температуры кипения менее удобно для оценки осмотического давления, так как нагревание раствора до температуры кипения может вызвать необратимые изменения в исследуемых образцах, особенно если предметом изучения служат биологические объекты.
Измерение депрессии пара для вычисления осмотического давления по уравнению (9 - 18) сопряжено со значительными техническими трудностями и требует длительного времени для установления равновесия.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими растворами . Раствор хлорида натрия, изотонический с плазмой крови человека, называется физиологическим раствором . Концентрация хлорида натрия в таком растворе равна 0,145  (несколько меньше 0,9 % ).
(несколько меньше 0,9 % ).
Для приближенных расчетов осмотического давления используется уравнение Вант-Гоффа. В связи с этим в медицинских и биологических исследованиях часто осмотическое давление выражают в относительных единицах, связанных с этим уравнением, - Осмолях (краткое обозначение - Осм). Осмотическое давление, отвечающее концентрации растворенного вещества 1  , равно 1 Осм. Если бы уравнение Вант-Гоффа выполнялось строго, то осмотическое давление физиологического раствора в этих единицах было бы равным 0,29 Осм = 290 мОсм (одной молекуле NaCl в растворе соответствуют две частицы: Na+ и Cl-).
, равно 1 Осм. Если бы уравнение Вант-Гоффа выполнялось строго, то осмотическое давление физиологического раствора в этих единицах было бы равным 0,29 Осм = 290 мОсм (одной молекуле NaCl в растворе соответствуют две частицы: Na+ и Cl-).
Дата добавления: 2015-07-24; просмотров: 1769;
