Частные случаи равновесия в непрерывных системах
Барометрическое уравнение
Барометрическое уравнение устанавливает зависимость давления газа по высоте. Существуют восходящие еще к Лапласу многочисленные методы вывода этого уравнения. В данном случае воспользуемся тем, что газ, находящийся в поле силы тяжести, является непрерывной системой, содержащей один компонент - газ с молярной массой М.
Химический потенциал газа зависит от его парциального давления, которое в данном примере совпадает с общим давлением на высоте h:
 ;
;
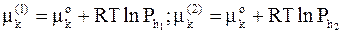 .
.
Величины, определяющие потенциал и фактор количества вещества, рассматривались в п.1. Их подстановка в уравнение (10 - 7) дает
 .
.
После преобразований получим
 . (10 - 8)
. (10 - 8)
Уравнение (10 - 8) называется барометрическим уравнением .
Распределение концентрации по высоте
В достаточно разбавленном растворе химический потенциал можно выразить через молярную концентрацию
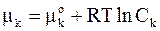 .
.
Если растворяемое вещество имеет плотность r2,, а растворитель - плотность r1, то потенциал в заданной точке выражается с учетом архимедовой поправки
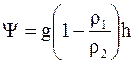 .
.
Подстановка соответствующих величин в уравнение (10 - 7) дает
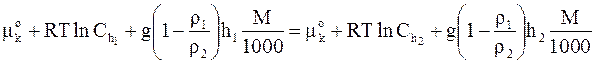
После преобразований получим
 . (10 - 9)
. (10 - 9)
Расчеты по уравнению (10 - 9) показывают, что для обычных молекул концентрация с высотой изменяется настолько слабо, что эти изменения экспериментально определить невозможно. Однако для коллоидных частиц, содержащих порядка тысяч первичных молекул, концентрация резко изменяется с высотой.
Для достижения заметного изменения концентрации макромолекул с высотой силу тяжести заменяют центробежной силой.
Равновесие в электрическом поле
При переносе одного моля ионов с атомным зарядом (+1) из точки с электрическим потенциалом j1 в точку с потенциалом j2 фактор количества вещества оказывается равным числу Фарадея F. Если переносится 1 моль ионов с зарядом z, то фактор количества составит zF. С учетом изложенного в системе (при отсутствии ассоциации частиц) в качестве условия равновесия можно принять
 . (10 - 10)
. (10 - 10)
Величина mech, определяемая равенством (10 - 10), называется электрохимическим потенциалом .
Электрохимический потенциал играет важную роль в электрохимии, особенно при построении модели двойного электрического слоя.
Определим концентрацию катионов, заряд которых в атомных единицах равен z+, и анионов с зарядом z- в точке с электрическим потенциалом j вблизи заряженной поверхности.
Для простоты примем зависимость химических потенциалов от концентраций ионов в форме
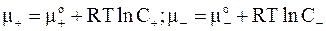 .
.
В этом случае электрохимические потенциалы ионов окажутся равными
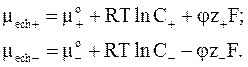
В объеме раствора (на относительно большом расстоянии от поверхности) электрический потенциал можно принять равным нулю. Если концентрации ионов в объеме равны 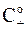 и
и  , то электрохимические равновесия можно описать уравнениями
, то электрохимические равновесия можно описать уравнениями

или
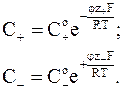 (10 - 11)
(10 - 11)
Алгебраическая сумма произведений концентраций ионов на их заряд равна плотности заряда в данной точке.
Более детально распределение заряженных частиц вблизи заряженной поверхности рассматривается в курсе коллоидной химии.
Дата добавления: 2015-07-24; просмотров: 687;
