Осмос. Осмотическое давление
Если в системе, находящейся при постоянной во всех точках температуре и одинаковом давлении, имеются части с разными величинами химического потенциала растворителя, то возникают процессы, приводящие к выравниванию химического потенциала растворителя во всех частях системы., т.е. к равновесию. Если предотвращается встречный поток растворенного вещества, то выравнивание химического потенциала можно обеспечить только односторонним потоком растворителя. Это явление называется осмосом.
Чаще всего встречный поток растворенного вещества предотвращается использованием специальных пористых мембран, способных пропускать сквозь себя молекулы растворителя, но не пропускать молекулы растворенного вещества. Такие мембраны получили название полупроницаемых. Особенно эффективно использование полупроницаемых мембран для растворов, в которых молекулы или ионы растворенного вещества намного больше молекул растворителя. Для растворов, в которых размеры молекул растворенного вещества близки к размерам молекул растворителя, подбор полупроницаемых мембран становится проблематичным. Для растворов нелетучего вещества в летучем растворителе наилучшей мембраной может явиться газовая среда, разделяющая части системы.
Кроме осмоса, через полупроницаемую мембрану возможен поток растворителя из раствора в чистый растворитель, т.е. в направлении, обратном осмотическому потоку. Это явление называется обратным осмосом . Он осуществляется при условии, что химический потенциал растворителя в растворе больше химического потенциала его в чистом растворителе.
 Для проведения обратного осмоса к раствору прикладывается избыточное давление. «Выдавливание» растворителя из раствора при обратном осмосе возможно, потому что химический потенциал растворителя зависит не только от активности растворителя, но и от давления. Повышение содержания растворенного вещества в растворе снижает термодинамическую активность растворителя. В свою очередь, повышение давления увеличивает химический потенциал, так как повышение возрастает энергию Гиббса. Поэтому при больших давлениях вызванное этим фактором увеличение химического потенциала становится соизмеримым с уменьшением, вызываемым уменьшением концентрации и, следовательно, уменьшением термодинамической активности растворителя.
Для проведения обратного осмоса к раствору прикладывается избыточное давление. «Выдавливание» растворителя из раствора при обратном осмосе возможно, потому что химический потенциал растворителя зависит не только от активности растворителя, но и от давления. Повышение содержания растворенного вещества в растворе снижает термодинамическую активность растворителя. В свою очередь, повышение давления увеличивает химический потенциал, так как повышение возрастает энергию Гиббса. Поэтому при больших давлениях вызванное этим фактором увеличение химического потенциала становится соизмеримым с уменьшением, вызываемым уменьшением концентрации и, следовательно, уменьшением термодинамической активности растворителя.
Равенство химических потенциалов
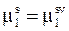 , (9 - 8)
, (9 - 8)
где 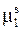 - химический потенциал растворителя в растворе,
- химический потенциал растворителя в растворе, 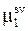 - химический потенциал чистого растворителя,
- химический потенциал чистого растворителя,
означает, что уменьшение термодинамической активности растворителя в растворе компенсируется увеличением давления, прилагаемого к раствору.
Избыточное по сравнению с чистым растворителем давление раствора, компенсирующее уменьшение термодинамической активности растворителя, называется осмотическим давлением П.
Зависимость между осмотическим давлением и термодинамической активностью растворителя можно найти, используя равенство (9 - 8).
Так как химический потенциал чистого растворителя 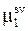 является постоянной величиной, то и химический потенциал растворителя в растворе
является постоянной величиной, то и химический потенциал растворителя в растворе 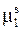 должен оставаться постоянным. Следовательно,
должен оставаться постоянным. Следовательно,
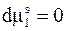 . (9 - 9)
. (9 - 9)
Химический потенциал является функцией термодинамической активности и давления 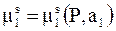 . Поэтому его полное приращение можно представить следующим образом:
. Поэтому его полное приращение можно представить следующим образом:
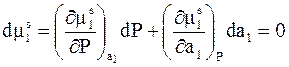 . (9 - 10)
. (9 - 10)
Для решения уравнения (9 - 10) воспользуемся равенствами
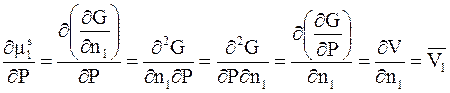 ;
;
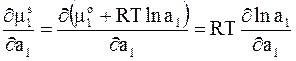 ,
,
где 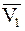 - парциальный молярный объем растворителя. Их подстановка в уравнение (9 - 10) дает
- парциальный молярный объем растворителя. Их подстановка в уравнение (9 - 10) дает
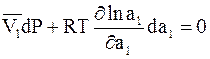 . (9 - 11)
. (9 - 11)
Интегрирование уравнения (9 - 11) можно проводить, исходя из того, что чистый растворитель находится под давлением Ро (атмосферное давление) и имеет активность, равную 1 (чистое вещество находится в стандартном состоянии). В связи с этим имеем
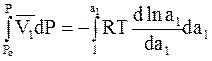 ;
;
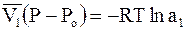 . (9 - 12)
. (9 - 12)
Учитывая, что избыточное давление раствора представляет собой осмотическое давление
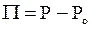 ,
,
получим окончательную форму уравнения
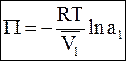 . (9 - 13)
. (9 - 13)
Уравнение (9 - 13) лежит в основе всех способов расчета осмотического давления.
Для разбавленных растворов можно воспользоваться уже применявшимися приближениями
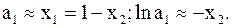
Подстановка приближенного значения активности растворителя в растворе в уравнение (9 - 13) дает зависимость осмотического давления от молярной доли растворенного вещества
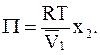 (9 - 14)
(9 - 14)
Если воспользоваться еще одним приближением для разбавленных растворов
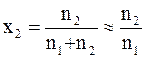 ,
,
то уравнение примет следующий вид:
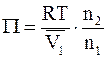 .
.
Для разбавленных растворов произведение парциального объема растворителя на число его молей можно считать равным объему всего раствора, т.е.
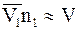 .
.
Отношение числа молей растворенного вещества к объему раствора, как известно, представляет собой молярную концентрацию раствора С2. Следовательно, уравнение для осмотического давления разбавленного раствора должно принять следующий вид:
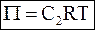 . (9 - 15)
. (9 - 15)
Уравнение (9-15) было предложено Я. Вант-Гоффом, и называется уравнением Вант-Гоффа.
По своему виду уравнение Вант-Гоффа почти полностью совпадает с уравнением состояния идеального газа для n2 моль газообразного вещества
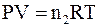 ,
,
что часто вызывает соблазн провести прямую аналогию между осмотическим давлением и давлением газа. Такая аналогия, предполагающая, что осмотическое давление создается ударами молекул растворенного вещества о стенки сосуда подобно ударам молекул газа, не имеет ничего общего с реальными явлениями. Если существует необходимость привести модель, объясняющую осмотические явления, то в этом случае лучше представить раствор в виде губки, впитавшей воду.
Представим, что сжатую губку погружают в воду и отпускают. Разжимаясь, губка впитывает в себя воду. Этот процесс является моделью осмотического всасывания. Сжатие впитавшей воду губки приводит к выдавливанию из нее воды, что можно рассматривать как модель обратного осмоса. Наконец, при определенной степени сжатия губки не происходит ни всасывания воды, ни ее выдавливания. В этом состоянии к губке прикладывается соответствующее усилие, которое имитирует осмотическое давление. Заметим, что при большем сжатии губки в ней содержится меньше воды. Таким образом, устанавливается аналогия между зависимостью осмотического давления от концентрации растворителя и зависимостью между усилием, прилагаемым к губке, и содержанием в ней воды.
Дата добавления: 2015-07-24; просмотров: 1029;
