Бинарные системы с одним летучим компонентом
Системы такого рода представляют собой раствор нелетучего вещества в летучем растворителе. Традиционно принято обозначать величины, относящиеся к растворителю, индексом 1, а величины, относящиеся к растворенному веществу, - индексом 2.
Согласно (6 - 45) летучесть растворителя f1 связана с его активностью в растворе а1 соотношением 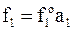 , в котором
, в котором 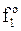 - стандартная летучесть растворителя при данной температуре.
- стандартная летучесть растворителя при данной температуре.
При постоянном внешнем давлении летучесть растворителя можно считать постоянной величиной. Поэтому, прологарифмировав равенство, получим
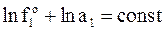 ,
,
а после дифференцирования по температуре имеем
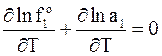 . (8 - 9)
. (8 - 9)
Согласно уравнению Клапейрона - Клаузиуса применительно к фазовому переходу из жидкости в пар, рассматриваемый как идеальный газ, производная логарифма давления по температуре равна 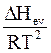 , где DHev - изменение энтальпии при испарении жидкости. Следовательно, производная логарифма летучести пара над чистым веществом также должна быть равна этой величине
, где DHev - изменение энтальпии при испарении жидкости. Следовательно, производная логарифма летучести пара над чистым веществом также должна быть равна этой величине
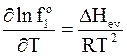 .
.
С учетом изложенного уравнение (8 - 9) принимает следующий вид:
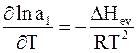 . (8 - 10)
. (8 - 10)
Уравнение (8 - 10) можно интегрировать, исходя из следующих условий:
* температурный интервал настолько мал, что энтальпия испарения не зависит от температуры;
* начальным состоянием системы является чистый растворитель, чему соответствуют а1 = 1 и Т = То (температура кипения чистого растворителя при данном давлении).
Проведем интегрирование:
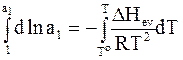 ;
;
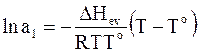 . (8 - 11)
. (8 - 11)
Для очень узкого температурного интервала с достаточной точностью можно принять
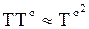 . (а)
. (а)
Обозначим повышение температуры кипения раствора Т по сравнению с чистым растворителем То через DТ:
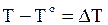 . (b)
. (b)
С учетом (а) и (b) запишем окончательную форму зависимости между термодинамической активностью растворителя и повышением температуры кипения раствора
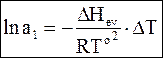 . (8 - 12)
. (8 - 12)
Для очень разбавленных растворов можно воспользоваться допущениями: a1»x1 и x2 <<1 (напомним, что х2 - молярная доля растворенного вещества). В этом случае
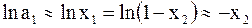 .
.
Вышеприведенные допущения позволяют установить зависимость между повышением температуры кипения раствора и содержанием в нем растворенного вещества
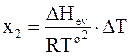 . (8 - 13)
. (8 - 13)
Для проведения дальнейших преобразований воспользуемся тем, что в разбавленном растворе число молей растворенного вещества во много раз меньше числа молей растворителя (n1>>n2).
Следовательно,
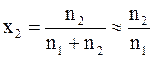 .
.
Для 1000 г растворителя, молярная масса которого равна М1, его количество составит 1000/M1 моль.
Способ выражения концентрации растворенного вещества отношением числа молей его к 1000 г растворителя называется моляльностью, которую обозначают m2 .
Таким образом, для разбавленных растворов получаем уравнение, связывающее повышение температуры кипения с моляльностью раствора:
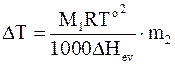 . (8 - 14)
. (8 - 14)
В уравнение (8 - 14) входят величины, являющиеся характеристиками растворителя: молярная масса, температура кипения и теплота испарения. Объединив их вместе с универсальной газовой постоянной в общую константу
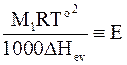 , (8 - 15)
, (8 - 15)
получим
 . (8 - 16)
. (8 - 16)
Уравнение (8 - 16), впервые экспериментально установленное Ф. Раулем, используется для определения содержания растворенного вещества в растворе по его температуре кипения. От латинского слова ebullio - кипеть произошло название этого метода. Его называют эбулиометриейили эбулиоскопией. Уравнение (8 - 16) называется основным уравнением эбулиометрии. Входящая в уравнение (8 ‑ 16) постоянная называется эбулиометрической постоянной.
Эбулиометрия используется для определения активности растворителя в разнообразных растворах, включая растворы электролитов.
Дата добавления: 2015-07-24; просмотров: 1039;
