Химические потенциалы веществ в реальных системах
Для того, чтобы найти зависимость химического потенциала вещества в газовой фазе от его летучести, проведем следующий воображаемый процесс.
Из системы, в которой газ i находится в стандартном состоянии и его химический потенциал равен mio , перенесем его бесконечно малое число молей dni в реальную систему, в которой летучесть газа равна fi, а химический потенциал равен mi.
Этот процесс сопровождается изменением энергии Гиббса
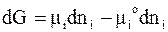 ,
,
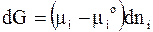 .(6 - 39)
.(6 - 39)
С другой стороны, изменение летучести от fo до fi приводит к изменению энергии Гиббса для 1 моль
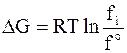 ,
,
а для dni молей изменение энергии Гиббса составляет
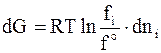 . (6 - 40)
. (6 - 40)
Приравнивая правые части равенств (6 - 39) и (6 - 40), получим
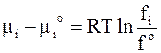 .
.
Включая стандартную летучесть в общую константу, окончательно имеем
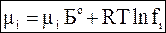 (6 - 41)
(6 - 41)
Уравнение (6 - 41) отражает зависимость химического потенциала от летучести в реальных газовых смесях.
Обратимся к реальным растворам в конденсированных системах.
Пусть имеются две системы: конденсированная система в виде вещества i в стандартном состоянии и реальный раствор, содержащий это вещество.
Совершим следующий воображаемый процесс.
Перенесем бесконечно малое число молей dni вещества i из первой системы во вторую и найдем изменение энергии Гиббса на всех стадиях этого процесса.
Квазистатический переход из чистой жидкости (или твердого вещества) в пар не приводит к изменению энергии Гиббса. Переход dni моль из пара над чистым веществом с летучестью fio в пар над раствором с летучестью fi приводит к изменению энергии Гиббса
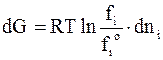 . (6 - 42)
. (6 - 42)
Последующий квазистатический переход из пара в жидкость не приводит к изменению энергии Гиббса. Таким образом, изменение энергии Гиббса для всего процесса определяется уравнением (6 - 42).
Если химический потенциал вещества i в стандартном состоянии равен mio, а химический потенциал в растворе равен mi, то изменение энергии Гиббса при переносе dni молей вещества из одной системы в другую можно представить следующим образом:
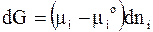 . (6 - 43)
. (6 - 43)
Из равенства правых частей уравнений (6 - 42) и (6 ‑ 43) следует
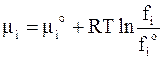 . (6 - 44)
. (6 - 44)
Уравнение (6 - 44), показывающее зависимость химического потенциала от состава конденсированной системы, имеет принципиальное отличие от подобного уравнения для газовых систем.
В газовых системах стандартная летучесть одинакова для всех газов, а для конденсированных систем стандартная летучесть является специфической величиной каждого вещества. Ее не включают в общую константу.
Отношение летучести вещества над его раствором к летучести в стандартном состоянии называется термодинамической активностьюai вещества в растворе
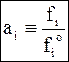 (6 - 45)
(6 - 45)
В идеальных растворах термодинамическая активность совпадает с молярной долей вещества и выражение (6 - 45) можно рассматривать как обобщение закона Рауля для реальных систем.
Нетрудно заметить, что
в стандартном состоянии термодинамическая активность вещества равна 1.
Введение термодинамической активности упрощает запись основного выражения для химического потенциала, придавая ему форму:
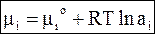 (6 - 46)
(6 - 46)
Дата добавления: 2015-07-24; просмотров: 723;
