Стандартное термодинамическое состояние для газов
Стандартное термодинамическое состояние было введено как общее начало отсчета летучести для всех газов.
Так как свойства всех газов различны, то в реальных условиях у них не может быть общих точек на кривой f=f(P). Следовательно, общее для всех газов состояние может быть только воображаемым.
Наиболее удобно предполагать, что все свойства у различных газов совпадут, если они превратятся (воображаемо!) в идеальные газы.
Исторически сложилось так, что в течение многих десятилетий в качестве единицы давления использовалась атмосфера (атм.), причем 1 атм равна 1,01325×105 Па. Нетрудно понять, что в стандартном состоянии газ должен находиться именно при этом давлении.
Хотя в последующие годы система единиц изменилась, давление идеального газа в стандартном состоянии осталось прежним, т.е. равным 1 атм.
Определение стандартного термодинамического состояния для газов таково:
Стандартное термодинамическое состояние газа при данной температуре представляет собой воображаемое состояние в виде идеального газа при давлении 1,01325×105 Па.
Рассмотрим процесс перехода газа из стандартного состояния в заданное состояние, которому соответствует летучесть f.
Будем придерживаться следующего обязательного условия:
Все величины, относящиеся к стандартному состоянию или отсчитываемые от него, обозначаются символом о, который ставится вверху справа от определяемой величины.
По этой причине в стандартном состоянии давление и равная ему летучесть будут обозначаться следующим образом: fo = Po =1.01325×105 Па.
Первая стадия перехода из стандартного состояния в заданное состояние газа включает расширение газа. Поскольку в стандартном состоянии он наделен свойствами идеального газа, то расширение его (не следует забывать, что речь идет об изотермической функции) должно происходить по изотерме идеального газа до очень маленького давления P* или летучести f*. Изменение энергии Гиббса на этой стадии равно
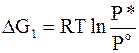 .
.
При очень малых давлениях свойства реального газа фактически совпадают со свойствами идеального газа. Поэтому различие между изотермами идеального газа и изотермами реального газа в этих условиях отсутствуют. В связи с этим переход с изотермы идеального газа на изотерму реального газа не вызовет никаких изменений в системе. Следовательно, для второго этапа процесса изменение энергии Гиббса окажется равным нулю.
Третий этап представляет собой сжатие по изотерме реального газа от летучести f* до летучести в заданном состоянии f. Изменение энергии Гиббса на этом этапе равно
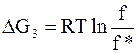 .
.
Общее изменение энергии Гиббса в результате всех этапов равно
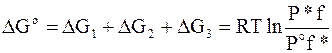 .
.
Так как Po =fo и f*»P*, то окончательно имеем
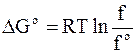 (6 - 37)
(6 - 37)
или
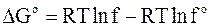 . (6 - 38)
. (6 - 38)
Дата добавления: 2015-07-24; просмотров: 893;
