Зависимость химического потенциала от состава идеальных газовых систем
Первыми идеальными системами, к которым мы обратимся, являются идеальные газовые смеси. Напомним, какими свойствами они обладают.
Смеси подчиняются уравнению состояния идеального газа
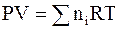 , (6 - 21)
, (6 - 21)
в котором ni - число молей газа i, и закону Дальтона, согласно которому общее давление смеси равно сумме парциальных давлений газов
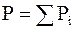 . (6 - 22)
. (6 - 22)
Для числа молей ni каждого газа выполняется уравнение
 . (6 - 23)
. (6 - 23)
При постоянной температуре для системы с постоянным объемом выполняются равенства:
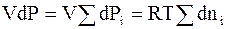 . (6 - 24)
. (6 - 24)
При постоянной температуре уравнение Гиббса - Дюгема (6 - 19) приобретает форму:
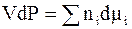 . (6 - 25)
. (6 - 25)
Из равенства левых частей уравнений (6 - 24) и (6 - 25) следует
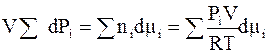 .
.
или
 . (6 - 26)
. (6 - 26)
В идеальной смеси газы не влияют друг на друга (ведут себя независимо). В связи с этим разность в каждой скобке должна быть равна нулю:
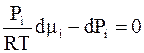 . (6 - 27)
. (6 - 27)
Напомним, что уравнение (6 - 27) выполняется при постоянной температуре. Его интегрирование дает
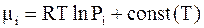 . (6 - 28)
. (6 - 28)
В уравнении (6 - 28) для каждой температуры получается своя постоянная интегрирования. Для краткости записи ее чаще всего обозначают mio. С учетом этого традиционная форма зависимости химического потенциала от парциального давления идеального газа приобретает следующий вид:
 (6 - 29)
(6 - 29)
При постоянном общем давлении и при постоянной температуре выполняется равенство
 .
.
Отношение числа молей данного вещества ni к общему числу молей Sni является молярной долей веществаxi.
Введем обозначение
 ,
,
с помощью которого выразим зависимость химического потенциала газа от его молярной доли в идеальной газовой смеси
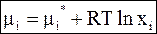 . (6 - 30)
. (6 - 30)
Дата добавления: 2015-07-24; просмотров: 893;
