Примеры использования характеристических функций. Уравнения Гиббса - Гельмгольца
Покажем возможности использования метода характеристических функций на примере вывода уравнения Клапейрона - Клаузиуса.
Ранее это уравнение было получено по методу циклов. Здесь мы используем свойства энергии Гиббса.
При равновесии двух сосуществующих фаз (жидкость ‑ пар, твердое вещество - жидкость, твердое вещество - пар) обе фазы находятся в тепловом равновесии (имеют общую температуру Т) и механическом равновесии (находятся при одинаковом давлении Р). При постоянных Р и Т условием равновесия является минимум энергии Гиббса. Следовательно,
G = Gmin; dG = 0.
Это означает, что насколько увеличится энергия Гиббса одной фазы, настолько уменьшится энергия Гиббса другой фазы:
dG = dG1 - dG2.
Переход из одной фазы в другую не сопровождается полезной работой, а только механической работой. Поэтому система, состоящая из двух фаз чистого вещества, является простой системой, и приращение энергии Гиббса каждой фазы определяется уравнением (5 - 25)
dG1 = V1dP - S1dT, dG2 = V2dP - S2dT.
Отсюда
(V1dP -S1dT) - (V2dP - S2dT) = 0
или
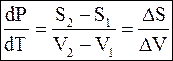 . (5 - 62)
. (5 - 62)
Уравнение (5 - 62) является новой формой уравнения Клапейрона -Клаузиуса.
Принимая во внимание уравнение (4 - 14), в соответствии с которым изменение энтропии при фазовом переходе определяется изменением энтальпии DHp.t., вновь возвращаемся к привычной форме уравнения Клапейрона - Клаузиуса:
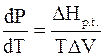 .
.
Используя энергию Гиббса и энергию Гельмгольца, можно сравнительно легко найти температурную зависимость полезной работы и полной работы системы.
Действительно, при постоянном давлении и постоянной температуре конечное приращение энергии Гиббса можно выразить следующим образом:
DG = D(H - TS) = DH - TDS (5 - 63)
Из выражения (5 - 32), устанавливающего равенство энтропии и производной энергии Гиббса по температуре со знаком минус, вытекает
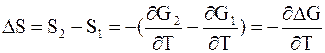 . (5 - 64)
. (5 - 64)
Подстановка (5 - 64) в (5 - 63) дает
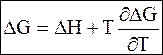 . (5 - 65)
. (5 - 65)
При постоянной температуре приращение энергии Гельмгольца в соответствии с равенством (5 - 12) равно
DF = DU - TDS. (5 - 66)
Используя равенства (5 - 30) и (5 - 66), получим
 . (5 - 67)
. (5 - 67)
Так как приращение энергии Гиббса при постоянных Р и Т равно полезной работе со знаком минус согласно равенству (5 - 45), а приращение энергии Гельмгольца - полной работе со знаком минус согласно равенству (5 - 47), то зависимость полезной работы и полной работы от температуры выражается следующим образом:
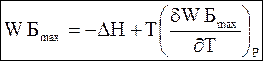 (5 - 68)
(5 - 68)
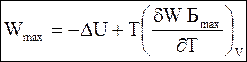 (5 - 69)
(5 - 69)
Уравнения (5 - 68) и (5 - 69) называют уравнениями Гиббса - Гельмгольца.
Очень часто в название уравнения Гиббса - Гельмгольца включают и генетически связанные с ними уравнения (5 ‑ 65) и (5 - 67). Более того, можно встретить использование этого названия для абсолютных значений функций
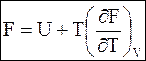 (5 - 70)
(5 - 70)
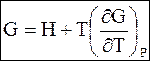 (5 - 71)
(5 - 71)
Уравнения (5 - 65), (5 - 67), (5 - 68) и (5 - 69) представляют собой дифференциальную форму уравнений Гиббса - Гельмгольца.
Интегрирование уравнения (5 - 65) проводят, используя очевидное равенство
 . (5 - 72)
. (5 - 72)
Разделив обе части равенства (5 - 65) на Т2, с учетом выражения (5 - 72) получим
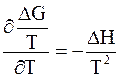 . (5 - 73)
. (5 - 73)
Форма (5 - 73) удобна для интегрирования. Разделив переменные, получим:
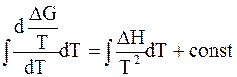 . (5 - 74)
. (5 - 74)
В случае интегрирования от нулевой температуры уравнение (5 - 74) принимает следующий вид:
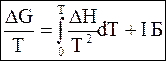 . (5 - 75)
. (5 - 75)
В уравнение (5 - 75) входит постоянная интегрирования I`.
Если в системе протекает химическая реакция, то температурная зависимость ее теплоты выражается уравнением Кирхгофа (2 - 10). Подставив в уравнение (2 - 10) в качестве нижнего предела интегрирования нулевую абсолютную температуру, получим
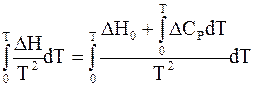 . (5 - 76)
. (5 - 76)
Подстановка правой части уравнения (5 - 76) в уравнение (5 - 75) приводит к полной интегральной форме уравнения Гиббса - Гельмгольца, из которой следует, что приращение энергии Гиббса, а также максимальную полезную работу и условие равновесия системы можно было бы определить только по термохимическим данным, т.е. по результатам калориметрических измерений изменения энтальпии и теплоемкости. Для этого достаточно было бы установить величину константы интегрирования I`.
Однако ни из первого, ни из второго начала термодинамики установить величину константы интегрирования невозможно. Более детально с проблемой нахождения константы интегрирования, которую иногда называют термодинамически неопределимой константой, и решением этой проблемы мы познакомимся в дальнейшем.
С помощью уравнений (5 - 65) и (5 - 75) могут решаться различные задачи.
Уравнение (5 - 75), как уже отмечалось, принципиально может быть использовано для расчета приращения энергии Гиббса по калориметрическим данным, а уравнение (5 - 65) - для приращения энтальпии по температурной зависимости максимальной полезной работы. Для этого используют уравнение (5 - 68) в следующей форме:
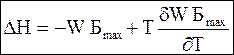 (5 - 77)
(5 - 77)
Интересно сравнить условия калориметрического определения приращения в ходе химической реакции и приращения энтальпии, определяемого по температурной зависимости максимальной полезной работы химической реакции.
Калориметрическое определение DН означает, что реакция проводится без совершения полезной работы, т.е. в абсолютно необратимом процессе, а DН, оцениваемое по температурной зависимости полезной работы, предполагает проведение квазистатического процесса.
Дата добавления: 2015-07-24; просмотров: 900;
