Основные свойства идеального газа
Как уже указывалось, идеальный газ является воображаемой системой, которой приписываются определенные свойства. Прежде всего зависимость между параметрами идеального газа устанавливается уравнением состояния (напомним, что оно относится к 1 моль газа или смеси различных газов)
PV=RT (3 - 1)
Еще одно свойство газов при низких давлениях, т.е. приближающихся по свойствам к идеальному газу, было установлено Гей-Люссаком и подтверждено Джоулем и другими исследователями. Оно заключается в следующем.
Если газ быстро (без теплообмена) выпускать в пустоту, то его температура не изменится. При вытекании газа увеличивается его объем и падает давление. В то же время при истечении газа в пустоту он не испытывает сопротивления среды и, следовательно, не совершает работу. Отсутствие работы и теплообмена означает, что внутренняя энергия газа не изменяется.
Таким образом, не вызывающее изменения внутренней энергии истечение газа в пустоту влияет на объем и давление, но не влияет на температуру.
Внутренняя энергия идеального газа зависит только от температуры.
Это утверждение, известное как закон Гей-Люссака - Джоуля, является вторым важнейшим свойством идеального газа.
Особенности идеального газа связаны также с его теплоемкостями.
Установлено, что теплоемкость газа при постоянном объеме Cv не зависит от температуры, но зависит от числа атомов, составляющих молекулу газа. В частности, для одноатомных молекул, к числу которых можно отнести атомы инертных газов, для теплоемкости Сv выполняется условие
 , (3 - 2)
, (3 - 2)
для двухатомных молекул -
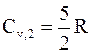 , (3 - 3)
, (3 - 3)
для молекул, состоящих из трех и более атомов -
 . (3 - 4)
. (3 - 4)
Используя уравнение состояния для идеального газа, его энтальпию можно выразить следующим образом:
H = U + RT. (3 - 5)
Изменение энтальпии можно записать так:
dH = dU + RdT. (3 - 6)
Из равенств (2 - 11) и (2 - 15) следует
CpdT = CvdT + RdT
или
Cp = Cv + R (3 - 7)
Равенство (3 - 7) известно под названием формулы Майера, выведшего ее в начале 40-х годов XIX в.
Дата добавления: 2015-07-24; просмотров: 1656;
