Влияние температуры на тепловой эффект реакции. Уравнения Кирхгофа
Температура может оказывать существенное влияние на тепловой эффект химической реакции. Иногда значительное изменение температуры может изменять дажезнак теплового эффекта (переход от экзотермической реакции к эндотермической или от эндотермической к экзотермической).
Уравнение, характеризующее влияние температуры на тепловой эффект химической реакции, можно вывести следующим образом.
Пусть энтальпии исходных веществ и продуктов реакции в соответствии с реакцией (2 - 1) равны
HA1, HA2, ..., HAi,... HA1`, HA2,` ..., HAj`,...
энтальпии энтальпии
исходных веществ продуктов реакции
Суммарная энтальпия исходных веществ выражается так:
Н1= SniHAi ,
а суммарная энтальпия продуктов реакции равна
H2 = Snj`HAj .`
Переход из исходного состояния в конечное, т.е. протекание реакции, приводит к изменению энтальпии
DH = H2 - H1 = Snj`HAj` - SniHAi , (2 - 6)
представляющему собой тепловой эффект реакции.
Дифференцируя равенство (2 - 6) по температуре при постоянном давлении, получим
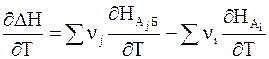 . (2 - 7)
. (2 - 7)
Напомним, что производная энтальпии вещества k по температуре является теплоемкостью при постоянном давлении
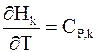 .
.
Поэтому равенство (2 - 7) приобретает следующий вид:
 (2 - 8)
(2 - 8)
Уравнение ( 2 - 8), отражающее зависимость теплового эффекта от температуры, называется уравнением Кирхгофа в дифференциальной форме.
Еще один тип уравнения Кирхгофа в дифференциальной форме относится к реакциям, проводимым при постоянном объеме:
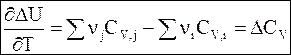 (2 - 9)
(2 - 9)
Интегрирование дифференциальных уравнений Кирхгофа в температурных пределах от Т1 до Т2 дает
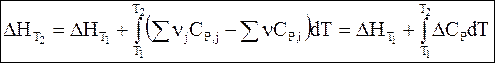 (2 - 10)
(2 - 10)
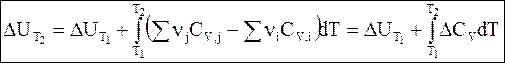 (2 - 11)
(2 - 11)
Обращаем внимание на то, что разности, заключенные в скобки, в уравнениях (2 - 10) и (2 - 11) затем обозначены символами DCP и DCV.
Уравнения (2 - 10) и (2 - 11) называются уравнениями Кирхгофа в интегральной форме. В них входят теплоты реакции при температуре Т1 ( 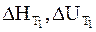 ) и при температуре Т2 (
) и при температуре Т2 ( 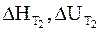 ).
).
Уравнения Кирхгофа позволяют рассчитывать тепловые эффекты реакций в широком диапазоне температур, используя только справочные данные. В частности, теплоту реакции при определенной температуре можно рассчитать на основе первого или второго следствия из закона Гесса, а затем по известным из справочной литературы значениям теплоемкости тепловой эффект рассчитывается для другой температуры.
В справочниках зависимость теплоемкости веществ от температуры, как правило, приводится в виде степенных рядов следующих типов:
CP = a + bT + cT2 + ...
CP = a + bT + c`T-2
Диапазон температур, для которого температурная зависимость теплоемкости выполняется, четко оговаривается. Проведение вычислений при температурах, выходящих за пределы (особенно верхние) диапазона, недопустимо.
Уравнения Кирхгофа позволяют решать и некоторые качественные задачи. Например, зная, что теплоемкость пара всегда меньше теплоемкости жидкости, можно утверждать, что с повышением температуры теплота (изменение энтальпии) испарения жидкости уменьшается.
Дата добавления: 2015-07-24; просмотров: 3456;
