Расстояние Н - Н
 Есв rравн
Есв rравн
Рис. 1. Образование молекулы Н2 в результате перекрывания атомных орбиталей водорода
Устойчивость двухатомной молекулы АВ к распаду на атомы характеризуется величиной энергии диссоциации молекулы, или прочностью связи А-В. Связь считается прочной, если ее энергия превышает 400 кДж/моль и слабой – если ее энергия меньше 100 кДж/моль. Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется. Прочность связи обычно уменьшается с увеличением ее длины. Одинарная связь всегда слабее, чем кратные связи – двойная и тройная – между теми же атомами.
Всего известно четыре основных вида химической связи: ионная, ковалентная, металлическая и водородная.
Ионная связь формируется за счет электростатических сил, существующих между частицами с зарядами противоположного знака, которые образуются за счет переноса одного или нескольких электронов от одного атома к другому.
Так, например, для ионного кристалла NaCl, образование ионов Na+ u Cl- из нейтральных атомов показывает, что атом натрия теряет электрон, а атом хлора его присоединяет. В результате этого образуются Na+ (2s22p6 – оболочка Ne) и Cl- (3s23p6 – оболочка Ar). Эти ионы формируют внутри кристалла правильную трехмерную структуру.
Ионы в кристалле находятся в равновесных положениях, поэтому силы кулоновского притяжения компенсируются силами отталкивания. Отталкивание обусловлено электроста-тическим отталкиванием электронных оболочек и ядер.
Взаимодействие между катионами и анионами в ионном кристалле не зависит от направления, и каждый катион может притягивать любое число анионов, и наоборот. По этой причине ионная связь в кристалле является ненаправленной и ненасыщенной, а число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл.
Идеальной ионной связи не существует. Даже в соединениях, которые обычно относят к ионным, не наблюдается полного перехода электронов от одного атома к другому. Электроны всегда частично остаются в общем пользовании. Так, например, связь во фториде лития на 80% ионная, а на 20% – ковалентная. По этой причине, правильнее говорить о степени ионности химической связи.
Доминирующая роль ионной связи проявляется в том случае, если взаимодействующие атомы сильно отличаются энергиями ионизации, электроотрицательностями и сродством к электрону.
Количественной оценкой полярности («ионности») связи могут служить эффективные заряды атомов. Атом более электроотрицательного элемента притягивает к себе электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд (-δ), который называют эффективным, а у его партнера появляется такой же положительный заряд (+δ). Так заряд натрия в NaCl равен δ = +0,75; в хлориде, оксиде и сульфиде магния заряд магния равен δ = +1, заряд алюминия в нитриде алюминия (AlN) равен δ = + 1,25.
Из выше изложенного следует, что для поваренной соли изображение молекулы с эффективными зарядами будет иметь вид: Na+δС1-δ (Na+0,75С1-0,75).
Известно выражение для зависимости между разностью электроотрицательностей ∆ЭО и степенью ионности связи ∆u:
∆u = 1 - ∆с = 1 – ехр [-0,25 ∙ (∆ЭО)2] (.2 )
Считается, что связь ионная если разность электроотрицательностей ∆ЭО ≥ 2,0 (по шкале Полинга). Если 0 < ∆ЭО < 2,0, то связь ковалентная, полярная; при ∆ЭО = 0 – связь ковалентная, неполярная.
Например, в оксидах натрия ∆ЭО = 2,51 и лития ∆ЭО = 2,4 связь ионная, а в бромиде магния MgBr2 (∆ЭО = 2,96 – 1,31 = 1,65) связь полярная ковалентная.
Разделение связи на ионную и полярную ковалентную в какой-то мере условно. Любая полярная молекула является аналогом электрического диполя и характеризуется дипольным моментом:
 |
m1 = q L , (3)
 где q = nе – заряд; n – целое или дробное число; L – расстояние между центрами зарядов; m – вектор, направленный от ( +) к ( - ).
где q = nе – заряд; n – целое или дробное число; L – расстояние между центрами зарядов; m – вектор, направленный от ( +) к ( - ).
Единицей измерения дипольных моментов служит Дебай (Д), равный 3,33.10 -30 Кл.м.
Дипольный момент сложной молекулы определяется как векторная сумма дипольных моментов всех ее связей. В том случае, если молекула АВn симметрична относительно линии каждой связи, суммарный дипольный момент такой молекулы, несмотря на полярность отдельеых связей А–В, равен нулю (СН4, SiCl4, SF6, ВеCl2, SO3 и др.) (рис.2):
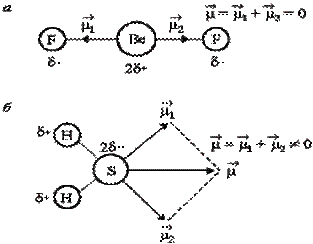
Рис. 2. Дипольные моменты неполярной молекулы ВеF2 (а) и полярной - Н2S (б)
КОВАЛЕНТНАЯ СВЯЗЬ.Большинство химических соединений не обладает характерными признаками ионных соединений. Для этих веществ Льюис создал модель образования ковалентной связи между атомами. Он предположил, что взаимодействующие атомы могут не передавать друг другу электроны, а обобществлять их, создавая, таким образом, электронную конфигурацию благородного газа.
Дата добавления: 2015-07-22; просмотров: 717;
