Структурные пространственные схемы для различного типа гибридизаций
| Базовая структура без несвязывающих электронных пар | 1 электронная пара | 2 электронные пары | 3 электронные пары | |
| sp | 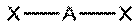 линейная BeCl2,
линейная BeCl2,
| |||
| sp2 | 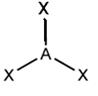 Тригональная плоская AX3
BF3, CO32−, NO3−, SO3
Тригональная плоская AX3
BF3, CO32−, NO3−, SO3
|  NO2 −, SO2 ,
AX2E1
NO2 −, SO2 ,
AX2E1
| ||
| sp3 | 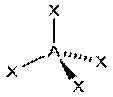 тетраэдрическая AX4
CH4, PO43−, SO42−,
тетраэдрическая AX4
CH4, PO43−, SO42−,
| 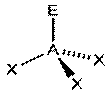 NH3, PCl3
AX3E1
NH3, PCl3
AX3E1
|  H2O, OF2
AX2E2
H2O, OF2
AX2E2
| |
| sp3d1 | 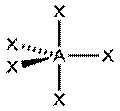 Тригональная бипирамида PCl5, AX5
Тригональная бипирамида PCl5, AX5
| 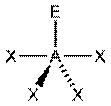 AX4E1, SF4
AX4E1, SF4
| 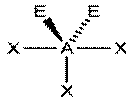 AX3E2, ClF3, BrF3
AX3E2, ClF3, BrF3
| 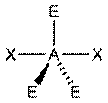 AX2E3, XeF2
AX2E3, XeF2
|
| sp3d2 | 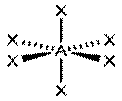 AX6
Октаэдрическая, SF6
AX6
Октаэдрическая, SF6
| 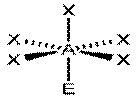 ClF5, BrF5
AX5E1
ClF5, BrF5
AX5E1
| 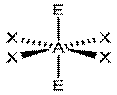 XeF4; AX4E2
XeF4; AX4E2
| |
| sp3d3 | 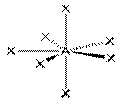 Пентагональная
бипирамида, IF7,
AX7
Пентагональная
бипирамида, IF7,
AX7
|  XeOF5−, TeCl62−, BiCl63−, AX6E1
XeOF5−, TeCl62−, BiCl63−, AX6E1
|
Таким образом, согласно метода Гиллеспи пространственное расположение атомов вокруг центрального атома в молекуле и вид гибридизации определяется числом и расположением всех валентных связывающих и несвязывающих электронных пар, окружающих атом.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ. Полное название метода – метод молекулярных орбиталей (МО) как линейная комбинация атомных орбиталей (ЛКАО). Метод МО рассматривает молекулу как единую систему, как единый коллектив взаимодействующих атомов с их ядрами и электронами, которые и образуют молекулярные орбитали (МО).
Процесс образования МО из атомных орбиталей (АО) является самопроизвольным и приводит к уменьшению общей энергии системы.
Основу метода МО составляют следующие положения: 1). Каждый электрон в молекуле находится на определенном энергетическом уровне, характеризующемся соответствующими квантовыми числами; 2) Энергетическому уровню отвечает МО или волновая функция, которая является полиядерной; 3) Общее число образующихся МО равно числу взаимодействующих АО, т.е. из n взаимодействующих атомных орбиталей образуется n молекулярных орбиталей.
Молекулярная волновая функция имеет тот же физический смысл, что и атомная, т.е. Y2 определяет плотность вероятности пребывания электронов в данной точке пространства. Заполнение электронами энергетических уровней в молекуле, также происходит по принципу минимума энергии и принципу Паули, согласно которому на одной молекулярной орбитали не может находиться более двух электронов.
Если волновую функцию изолированного атома А обозначить через Yа, а волновую функцию изолированного атома В - Yв, то, согласно методу ЛКАО, волновая функция молекулы представляет линейную комбинацию атомных волновых функций:
Yав = С1Yа ± С2Yв, ( )
где Сi – коэффициенты, учитывающие долю участия атомных орбиталей атомов А и В в образовании МО.
Сложение Yав = С1Yа + С2Yв означает, что оба электрона проводят большую часть времени между двумя ядрами, где реализуется наибольшая электронная плотность, что и способствует связыванию атомов. Такую МО называют связывающей и обозначают (ss), (sр) и т.д. Заселение связывающей МО электронами приводит к понижению энергии молекулы и повышению ее устойчивости.
При вычитании функций Yав = С1Yа – С2Yв электронная плотность направлена в разные стороны от атомов, концентрируется за ядрами, а между ядрами она мала и практически равна нулю. Такое расположение электронной плотности растягивает межатомную связь, делая ее непрочной. Такую орбиталь называют разрыхляющей, и обозначают (s*s), (s*р)и т.д.
Заселение разрыхляющих орбиталей электронами приводит к повышению энергии молекулы и понижению ее устойчивости в целом.
В молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть обозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей(σ*) молекулярными орбиталями (рис. 6).

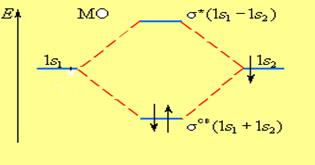
Рис. 6. Энергетическая диаграмма атомных и молекулярных уровней водорода
Таким образом, переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H – H.
На рис.7 А и Б показано перекрывание рz - АО, т.е. р - орбиталей, вытянутых вдоль оси z, которой мы назовем линию, соединяющую ядра атомов и py-АО. При этом образуются связывающая и разрыхляющая МО.
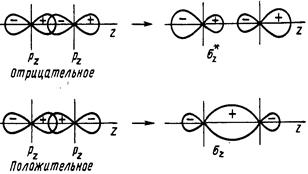
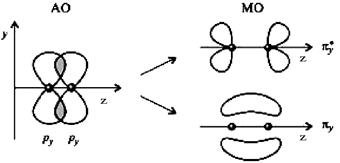
А) Б)
Рис. 7. Схема образования σz - связывающих и σ*z - разрыхляющих орбиталей (А) и πу-связывающих и πу*-разрыхляющих орбиталей (Б), образованных из р-атомных орбиталей
В методе МО ЛКАО атомные орбитали должны удовлетворять ряду определенных условий для возникновения МО:
1) взаимодействующие атомные орбитали должны обеспечить максимальное перекрывание электронных облаков;
2) перекрывающиеся АО должны иметь соизмеримо близкие энергии. Если АО сильно отличаются по энергиям, то и волновые функции будут сильно отличаться по частотам (Е = hν) и не будут давать интерференционного эффекта - складывания волн. В этом случае связывания взаимодействующих АО в МО не происходит.
Поэтому более прочные ковалентные связи наблюдаются при перекрывании - s-s- и p-p-орбиталей, близких по энергиям, а перекрывание s- и p-орбиталей, не приводит к образованию связей, если разница в энергиях между ними велика, либо приводит к образованию менее прочных связей, когда энергии этих орбиталей соизмеримы;
3) АО должны обладать одинаковыми свойствами симметрии относительно оси вращения вокруг линии связи в молекуле. Орбиталь является симметричной, если при повороте ее на 180о вокруг линии связи между атомами знак волновой функции не меняется и, наоборот, антисимметричной, если знак функции меняется на противоположный. Симметричные и антисимметричные атомные орбитали не могут образовывать МО
Порядок связи.В методе МО понятие валентности как таковой теряется, поскольку даже спаренные электроны различных уровней заселяют те или иные МО. Вместо понятия валентности или кратности связи в методе МО вводится новое понятие – порядок связи.
Порядок связи определяется как разность числа электронов, находящихся на связывающих орбиталях и числа электронов на разрыхляющих орбиталях, деленная на два. В методе МО порядок связи играет такую же роль, что и валентность в методе ВС:
ПС = (∑(е)связ - ∑(е)раз)/2. ( )
Если ПС = О, то система неустойчива и связь не возникает, так как для образования соединения всегда необходимо, чтобы заселенность связывающих МО была выше, чем заселенность разрыхляющих. Образование системы энергетически выгодно и она устойчива, если ПС > О. Чем выше порядок связи, тем, при прочих равных условиях, прочнее данная молекула.
Если порядок связи равен единице, то связь следует считать одинарной, двум – двойной, однако параметр может иметь и промежуточные значения. Например, для иона Н2+ ПС = 0,5.
Система: электрон - вакантная орбиталь (1 : 0). В данной системе на связывающей МО располагается всего лишь один электрон. Порядок связи в этом случае дробный. Проиллюстрируем это на примере образования Н2+ - иона, который обнаружен экспериментально. Образование Н2+ из атома водорода Н, в котором имеется один s – электрон, и иона Н+, не содержащего электронов и имеющего свободную атомную орбиталь: H[1s] + □ H+ = H2+ [σs, 1s]. Порядок образующейся ковалентной связи при этом равен ПС = (1 – 0)/2 = 0,5.
Н АО H2+ МО Н+АО
ss*
 |
 ss
ss

Система: электронная пара - электрон (2 : 1)
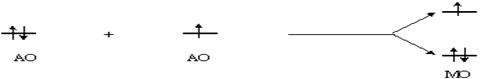
Порядок ковалентной связи в этом случае также равен ПС = (2-1)/2 = 0,5. Данная схема применима, например, к молекулярному иону Не2+.
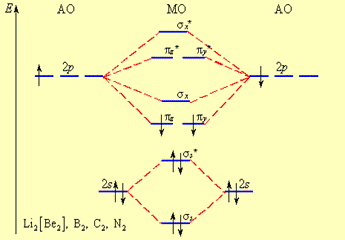
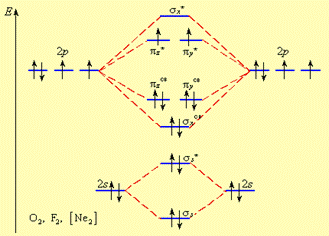
МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ ДВУХАТОМНЫХ МОЛЕКУЛ II ПЕРИОДА.Распределение электронов по молекулярным орбиталям в двухатомных молекулах второго периода от O2 до Ne2 осуществляется в следующем порядке:
s1s < s*1s < s2s < s*2s < s2рх < p2py = p2pz < p*2py = p*2pz < s*2рх
B ряду более легких элементов от Li2 до N2 последовательность заселения МО другая:
s1s < s*1s < s2s < s*2s < p2py = p2pz < s2рх < p*2py = p*2pz < s*2рх
На рис. 8 А и Б представлены две схемы заполнения МО на примере молекул второго периода. Из рисунков следует, что порядок заполнения МО в первом и втором случаях отличаются, что связано с тем, что для легких элементов начала II периода 2s - и 2р - орбитали близки по энергии (<6 эВ) и при формировании МО могут «смешиваться» s и p - орбитали. Для элементов O2 - Ne2 2s - и 2р – орбитали имеют в 3 – 5 раз большую разность в энергиях. Например, для кислорода и фтора разность в энергиях составляет ∆Е = 14,9 (O2) и 20,4 эВ (F2) соответственно и эффекта «смешивания» в этом случае не наблюдается.
А) Б)
Рис. 8. Пример заселения МО электронами для B2 (начало II периода) (А) и для О2 (Б)
Из рис.8Б видно, что порядок связи в молекуле кислорода равен двум, так как на шесть связывающих электронов, приходится два неспаренных электрона на разрыхляющих орбиталях: ПС = (6 – 2)/ 2 = 2.
ГЕТЕРОАТОМНЫЕ МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ.Подобным же образом рассматривается с точки зрения метода МО образование молекул, состоящих из различных атомов.Однако в отличие от гомоядерных эти молекулы образованы атомами с неодинаковыми зарядами ядер атомов.
В случае гетероядерных молекул связывающие молекулярные орбитали находятся ближе к орбиталям более электроотрицательного атома (рис. 9). Это означает, что электрон большую часть времени проводит у более электроотрицательного атома, а сама молекула представляет собой диполь.Общую схему образования гетероядерных МО для молекул типа АВ покажем на примере молекулы гидрида лития.. Здесь Δи – мера ионности, которая равна разности ∆ЭО взаимодействующих атомов; Δс – мера ковалентности. Электроотрицательность атома водорода равна 2,1, а атома лития – равна единице. Это полярная молекула и электронная плотность смещена к атому водорода.
 Е АО Li МО LiH АО Н
Е АО Li МО LiH АО Н
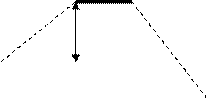 |
Рис. 9. Схема образования гетероядерных
Ψа Δс МО для молекул типа АВ




Δи Ψ в



 Δс
Δс
Таблица 2
Дата добавления: 2015-07-22; просмотров: 5290;
