Основные положения метода валентных связей
- Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
- Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
- Характеристики химической связи определяются типом (s, p, d) атомных орбиталей (АО).
- Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Обобществление электронной пары осуществляется либо по обменному механизму, когда каждый из взаимодействующих атомов поставляет по одному электрону для связи, либо по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
1. Обменный механизм Н.+ .С1::: = Н: С1:::

 2. Донорно-акцепторный механизм А + :В = А : В Здесь - свободная орбиталь атома А.
2. Донорно-акцепторный механизм А + :В = А : В Здесь - свободная орбиталь атома А.
При обменном механизме электронная пара, образующая связь, может образоваться как за счет неспаренных электронов, имеющихся в невозбужденном атоме, так и за счет распаренных электронов, образующихся при возбуждении атома. Например, в невозбужденном состоянии атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s - электронов переходит на p - подуровень:
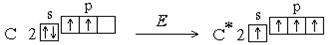
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Так как валентность атома зависит от числа неспаренных электронов, возбуждение атома приводит к повышению его валентности.
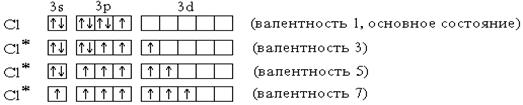
Элементы 3-го периода пятой, шестой и седьмой групп (фосфор, сера и хлор) могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня. На примере атома хлора легко показать, что валентность может быть переменной:
Ковалентная связь может быть полярной и неполярной. Неполярная связь образуется, когда молекула составлена из атомов одинаковой природы с равными ЭО, например, Н2, F2, С12 и О2. (так называемая гомополярная связь). В этом случае, общая пара электронов располагается симметрично относительно взаимодействующих атомов. Рассмотрим это на примере образования молекулы фтора.
 F ns2 np5 F F
F ns2 np5 F F













 F
F 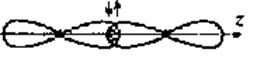
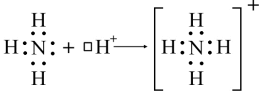 ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ.Ковалентные связи могут образовываться и за счет спаренных электронов, имеющихся на внешнем электронном слое одного из атомов. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить представленной схемой. Изображение электронов крестиками и точками на схеме весьма условно, так как в действительности электроны неразличимы. При образовании положительно заряженного катиона аммония, входящий в состав молекулы аммиака азот поставляет пару электронов и является донором, а ион Н+, имеющий свободную АО и принимающий электроны, является акцептором. Донорно-акцепторная связь по своим свойствам ничем не отличается от обычной ковалентной связи, образованной по обменному механизму.
ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ.Ковалентные связи могут образовываться и за счет спаренных электронов, имеющихся на внешнем электронном слое одного из атомов. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить представленной схемой. Изображение электронов крестиками и точками на схеме весьма условно, так как в действительности электроны неразличимы. При образовании положительно заряженного катиона аммония, входящий в состав молекулы аммиака азот поставляет пару электронов и является донором, а ион Н+, имеющий свободную АО и принимающий электроны, является акцептором. Донорно-акцепторная связь по своим свойствам ничем не отличается от обычной ковалентной связи, образованной по обменному механизму.
Таким образом, число возможных связей у атомов зависит не только от количества неспаренных электронов у атомов, но и от числа вакантных орбиталей одного атома и количества неподеленных электронных пар у другого атома соответственно.
Обобществление одной пары электронов является частным случаем ковалентной связи. Во многих молекулах атомы приобретают полный октет электронов, обобществляя больше одной пары электронов, например: Н2С = СН2; НС≡СН; N≡N; О = С = О.
Число связей, образующихся между атомами, называется кратностью, или порядком связи.
Для примера рассмотрим образование типы и кратность связей в молекуле СО.







 С
С
 |  |  |








 :С ≡ О:
:С ≡ О:
О
2s 2p
Электронная структура валентных электронов атома углерода в нормальном состоянии 2s22p2. Невозбужденный атом углерода имеет два неспаренных p - электрона, которые могут образовать две общие электронные пары (2 связи) с двумя неспаренными электронами атома кислорода (электронная конфигурация 2s22p4 ) по обменному механизму. Однако имеющиеся в атоме кислорода два спаренных р - электрона могут образовать и третью химическую связь, поскольку в атоме углерода имеется одна незаполненная р - орбиталь, которая может принять эту пару. Таким образом, дополнительно образуется третья связь по донорно-акцепторному механизму: Кратность связи в молекуле СО равна трем.
НАСЫЩАЕМОСТЬ И НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную ковалентность элемента в данном соединении.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания атомных орбиталей, которая совпадает с линией, соединяющей взаимодействующие атомы (см., например, рис.2Б).
Исключение составляют s - электронные АО, сферическая форма которых делает все направления равноценными.
Таким образом, образование ковалентной связи является результатом перекрывания валентных атомных орбиталей АО, которые характеризуются определенными ориентациями в пространстве, и поэтому ковалентная связь имеет строго определенную направленность.
Направление ковалентных связей характеризуется валентными углами – углами между линиями, соединяющими связываемые атомы в молекуле. Совокупность длин связей и валентных углов определяет пространственное равновесное строение молекулы, в которой имеет место равенство сил притяжения и отталкивания и которое обеспечивает минимальное значение ее энергии. Между двумя атомами в химическом соединении возможна только одна σ - связь. Совокупность направленных, строго ориентированных в пространстве σ - связей создает пространственную структуру молекулы вещества.
|
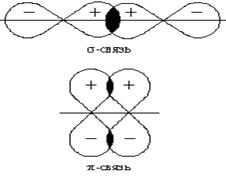
Для р - и d – электронных облаков перекрывание может осуществляться как вдоль оси, по которой они вытянуты, так и в параллельном направлении В первом случае образующаяся связь называется σ-связью (см. схему и рис.3).
После образования между двумя атомами σ-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется π - связь. Она менее прочна, чем σ-связь: перекрывание происходит диффузионными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну σ-связь.


Рис. 3. Схемы образования σ-связей с участием электронных АО различных типов

Рис. 4. Схемы образования π-связей с участием электронных АО различных типов
Таким образом, химическая связь характеризуется энергией, длиной, направленностью, кратностью, насыщаемостью и полярностью. Для молекул, состоящей более чем из двух атомов, существенными являются величины углов между связями и полярность молекулы в целом.
Валентность – это способность атома к образованию химических связей. Согласно обменному механизму, валентность элементов определяется числом содержащихся в атоме одноэлектронных атомных орбиталей. Для s-, p- элементов – это электроны внешнего уровня, для d- элементов – внешнего (s) и предвнешнего (d) подуровня.
ГИБРИДИЗАЦИЯ И ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ.В нормальном состоянии атом углерода имеет следующую электронную структуру:
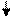


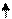
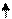


 С
С
2s 2p
Казалось бы, что за счет имеющихся двух неспаренных электронов углерод может образовать две ковалентные связи (одну σ- и однуπ-связь). Между тем для углерода более характерны соединения, в которых каждый его атом связан с соседними четырьмя ковалентными связями (СО2, СН4, С2Н6 и т.д.). Это оказывается возможным благодаря тому, что при затрате небольшого количества энергии один из имеющихся спаренных s-электронов можно перевести на подуровень 2р, в результате чего атом переходит в возбужденное состояние. В этом случае число одноэлектронных атомных орбиталей возрастает до 4-х и наблюдается вырождение (выравнивание энергий) самих АО



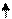






 С С*
С С*
2s 2p
Теперь во внешнем электронном слое углерода находятся четыре одноэлектронных атомных орбитали, которые могут участвовать в образовании четырех ковалентных связей. Процесс смешивания и вырождения АО называется гибридизацией, для него характерно образование «равноценных» или вырожденных орбиталей, которые имеют отличную от s - и р - орбиталей форму и усредненную энергию.
В целом процесс гибридизации включает следующие этапы: возбуждение атома, гибридизация орбиталей возбужденного атома и образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями.
Таким образом, гибридизация– это изменение энергии и формы атомных орбиталей одного или нескольких энергетических уровней, обеспечивающих достижение более эффективного перекрывания орбиталей. В результате, обеспечивается максимальная перекрываемость АО, минимум энергии молекулы и достигается большая прочность связей между атомами.
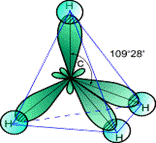
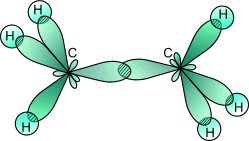
sp3-Гибридизация. В случае углерода и образования четырех σ-связей имеем так называемую sp3-гибридизацию (1 - s и 3 - р электрона).
Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» sp3-орбитали, угол между осями которых равен 109°28':

|
| 
|
CH4 С2Н6
Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, CС14, С2Н6).
sp2 -Гибридизация. Данный вид гибридизации характерен для атомов IIIА группы, например, В и А1 (ns2 nр1). Три sp2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Примером молекулы, в которой осуществляется этот вид гибридизации, может служить молекула фторида бора ВF3:
 |
 В
В
2s 2p
 |
 В*
В*
Схема возникновения гибридных орбиталей в этом случае выглядит следующим образом.Одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°: Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию. Ниже приведены модели и геометрия молекул ВН3 и ВС13:


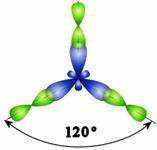
ВН3 ВС13
sp-Гибридизация. sр - гибридизация характерна для IIА группы периодической системы элементов Ве, Мg, Ca, Ba, Zn, Cd и Hg.



 Ве
Ве
2s 2p
Поэтому для участия в образовании химических связей по обменному механизму атом Ве должен перейти в возбужденное состояние:
 |
 Ве*
Ве*
В этом случае возбужденный атом Ве имеет два неспаренных электрона и может образовывать две связи с другими атомами.
Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Две sp-орбитали могут образовывать две s-связи (BeH2, ZnCl2). Молекула гидрида бериллия выглядит следующим образом:
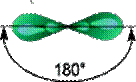
|

|
H Ве H
Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию. Такой же вид гибридизации и такую конфигурацию имеют молекулы MgС12, CaС12 и SrС12.
Следует иметь в виду, что гибридизация осуществляется только по σ- связям, а π - связи участия в гибридизации не принимают. Например, в этилене тип гибридизации для углерода не sp3, а sp2.
Во всех ацетиленовых углеводородах, имеющих в молекуле одну тройную связь: C2H2, C4H6, C6H10 и других органических соединениях со связями -С ≡ С- наблюдается sp-гибридизация..
В ацетилене две гибридные орбитали атомов углерода образуют две σ-связи с соседним атомом углерода и атомом водорода, а две негибридные, сформированные за счет перекрывания pz - и pу - орбиталей углерода образуют две π-связи. Между С и Н всегда формируется σ - связь.
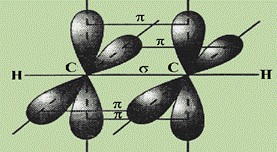
Рис. 5. Схема перекрывания АО в молекуле ацетилена
В некоторых случаях в гибридизации участвуют не образующие связь валентные электронные пары центрального атома, так называемые несвязывающие электронные пары. Пространственную конфигурацию молекулы или иона и тип гибридизации определяет суммарное число связывающих и несвязывающих электронных пар.
Для объяснения строения молекул, их геометрической формы и типа гибридизации, используется теория так называемых локализованных электронных пар (метод Гиллеспи).
ТЕОРИЯ ЛОКАЛИЗОВАННЫХ ЭЛЕКТРОННЫХ ПАР (МЕТОД ГИЛЛЕСПИ).В основе метода Гиллеспи лежит модель отталкивания локализованных электронных пар. Предполагается, что каждая пара электронов, окружающая атом, обозначаемая в формулах двумя точками, образуют электронные облака, которые вследствие отталкивания располагаются на друг от друга как можно дальше..
Реальная геометрия молекулы определяется не только числом σ – связей, но и количеством неподеленных электронных пар (Е). Тогда молекула метана соответствует формуле CH4, аммиака – NH3E, воды – H2OE2 и при этом будет наблюдаться одинаковая гибридизация (рис.5). У азота на sp3-гибридных орбиталях, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая (неподеленная) электронная пара. Именно она, занимая четвертую sp3- гибридную орбиталь, искажает угол связи H–N–H до 107,3° (в метане, например, где неподеленных электронных пар нет, угол равен 109,5о). В молекуле H2O таких несвязывающих неподеленных пар две, и угол H–O–H равен не 90о (если бы не было гибридизации), а 104,5о (рис. 5).
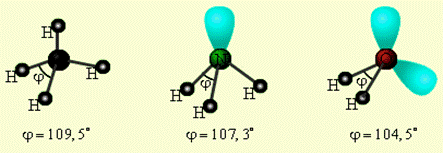
CH4 : NH3 H2O::
Рис. 5. Несвязывающие электронные пары и углы связи в NH3, H2O и CH4
Для трехатомной молекулы AX2, не имеющей неподеленные электронные пары, возможно единственное строение – линейное; четырехатомная молекула AX3 будет плоской в форме равностороннего треугольника; пятиатомная AX4 – тетраэдрической; шестиатомная AX5 будет иметь форму тригональной бипирамиды, а семиатомная AX6 – форму октаэдра.
Иное дело – наличие в молекуле неподеленных электронных пар. В этом случае геометрия молекулы существенно меняется. Молекула AX2E будет уже не линейной, а угловой, AX3E будет иметь форму треугольной пирамиды, а AX2E2 вновь будет угловой, причем угол будет существенно меньше тетраэдрического (например, H2O). В молекуле AX4E возможная структура – треугольнопирамидальная. Молекула AX5E имеет структуру квадратной пирамиды, а молекула AX4E2 – октаэдра (см. табл.1).
Таблица 1
Дата добавления: 2015-07-22; просмотров: 3167;
