Или ΔΗ расстояние до интересующей нас линии от стандарта, измеренное в Гц или Гс.
Так как можно измерять только относительные величины, то необходимо пользоваться стандартом, по отношению к которому определяются величины химических сдвигов.
Существует два вида стандартов: внешний (обычно запаянный в капиляр и помещенный внутрь ампулы исследуемым раствором) и внутренний (смешанный с исследуемым раствором). Известно, что при использовании внешнего стандарта, магнитное поле воздействующее на образец несколько отличается от поля, воздействующее на стандарт, и что это отличие меняется от соединения к соединению. Поэтому для надежного измерения химического сдвига при использовании внешнего стандарта необходима серия измерений с последующим введением расчетных поправок для величины химического сдвига. Поправка на магнитную восприимчивость ввиду трудоемкости этого метода чаще используют внутренний стандарт, который растворяют непосредственно в исследуемом образце. И стандарт и исследуемое вещество взаимодействуют с одним и тем же магнитным полем и для разбавленных растворов (<15%) удается достаточно надежно определить химический сдвиг.
В качестве эталона в ЯНР-спектрах 1Н и 13C используют, как правило, линию поглощения тетраметилсилана (ТМС). Применение ТМС удобно по нескольким причинам. Во-первых, его спектр только одну узкую линию (все ядра 1Н и, соответственно, 13C в молекуле ТМС эквивалентный). Эта линия обычно удалена от других (за исключением кремнийсодержащих органических соединений) и поэтому её легко идентифицировать. Во-вторых, ТМС инертен, т.е. не образует продуктов взаимодействия либо каких-то ассоциатов с другими органическими соединениями. В-третьих, ТМС растворим во многих органических растворителях. Он летуч и легко может быть удален из раствора после снятия спектра. ТМС, однако, не растворим в Д2О и не может быть использован при снятии ЯМР-спектров водных растворов. В вводных растворах часто применяют в качестве стандарта натриевую соль 2,2-диметил-2-силапентилсульфоновой кислоты (ДСС), хотя она и не летуча и, помимо пика, характерного для СН3-Si, имеет также ряд других пиков (которые также могут быть легко идентифицированы). В водных растворах можно использовать и другие растворимые в воде стандарты – ацетон, диоксан или третбутиловый спирт.
При измерении химических сдвигов в шкале δ, сигнал ТМС принимается равным нулю, а химическим сдвигом, расположенным в области меньших полей приписывается положительный знак и δ при этом увеличивается. Коме того в ЯМР 1Н применяют шкалу τ. В ней химический сдвиг линии ТМС принят равным 10 м.д. При переходе к низким полям значения τ уменьшаются. δ и τ связаны между собой следующим соотношением:
δ = 10 – τ.
Опыт показывает, что в подавляющем большинстве случае изменение среды (растворителя, резкое изменение концентрации или температуры раствора) приводит к лишь незначительному изменению в ЯМР-спектрах для протонов, связанных с атомом углерода. Это влияние гораздо больше для протонов, связанных с гетероатомами, которые способны к образованию водородных связей, либо других взаимодействий. Таким образом, химические сдвиги протонов, связанных с атомом углерода, определяются, в первую очередь, структурой молекулы и относительно слабо зависят от природы растворителя и концентрации раствора. Это важное обстоятельство позволяет сравнивать химические сдвиги, полученные в различных растворителях.
Анализ ЯМР-спектров ЯМР 1Н и 13C большинства органических соединений показывает, что химический сдвиг достаточно характеристичен. Это означает, что в большинстве случаев химический сдвиг протонов определяется, в первую очередь, ближним электронным окружением, простирающимся на две-три связи от данного протона. Например, протоны OCH3-лежат в области 3,3-3,9 м.д. независимо от того, к какой структуре принадлежит данная функциональная группа. ЯМР-сигналы многих других групп также расположены в достаточно узком диапазоне значений δ, и что особенно важно, области поглощения наиболее часто встречающихся групп не перекрываются. Отклонение химических сдвигов 1Н за пределы обычных диапазонов иногда характерно для молекул, содержащих магнитно-анизототропные группы с электронными токами, обуславливающими значительное экранирование на далеком расстоянии. К числу таких групп следует отнести, в первую очередь ароматические циклы и гетероциклы.
В ещё большей степени характеристичны сигналы в спектре ЯМР13C для углеродных атомов.
Химические сдвиги протонов, связанных с атомом кислорода, и меньшей степени, при атомах азота менее характеристичны. Это объясняется, в основном, их склонностью к образованию внутри- и межмолекулярных водородных связей, и также к протонному обмену. В результате, диапазон химических сдвигов групп –OH и –NH весьма широки, даже если измерения проводятся в одном и том же растворителе и при одинаковых концентрациях.
Механизмы экранирования.
На химический сдвиг протонов в ПМР влияют различные факторы. Грубо всё магнитное экранирование данного ядра удобно разбить на три составляющие: 1) Атомный вклад σа- он отражает влияние ближайшего электронного окружения данного ядра; 2) Молекулярный вклад, отражающий влияние соседних атомов и групп (σм ), а также межатомное внутримолекулярное движение электронов; 3) Составляющая σ΄, обусловленная межмолекулярными взаимодействиями и магнитными свойствами образца в целом. В конечном итоге
σ = σа + σм + σ΄ и δ = σэталона - σ Первые два вклада в магнитное экранирование σа и σм характеризуют структуру молекул исследуемого вещества. Межмолекулярная составляющая σ΄ определяется внешними факторами: температурой образца, межмолекулярными взаимодействиями, характером.
Атомный вклад (σа). Его можно в свою очередь разделить на диамагнитный и парамагнитный. Так как парамагнитная составляющая учитывает в основном волновые функции возбужденного состояния и ввиду высокой энергии возбуждения 1S орбитали водорода невелика, поэтому в σа основной вклад вносит диамагнитная составляющая.
растворителя.
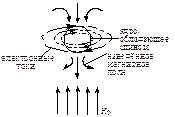
Возникновение диамагнитной составляющей показано на рисунке. Поле Н0 индуцирует электронные токи, перпендикулярные направлению полю Н0. Эти возникшие диамагнитные токи сопровождаются появлением вблизи ядра небольшого магнитного поля, противоположного магнитному полю. Т.е. диамагнитное экранирование всегда уменьшает Н0 и таким образом приводит к положительному экранированию. Степень экранирования зависит от электронной плотности вокруг протона, чем выше электронная плотность, тем сильнее экранирование. Этим, например, объясняется чёткое соответствие данных по экранированию и электроотрицательности в простых органических молекулах.
| Соединение | CH3I | CH3Br | CH3Cl | CH3F |
| Хим. сдвиг, δ | 2,16 | 2,68 | 3,05 | 4,26 |
| Электроотрицательность по Полингу | 2,5 | 2,8 | 3,0 | 4,0 |
Видно, что наиболее электроотрицательный атом фтора обуславливает и сильное уменьшение экранирования => можно сделать вывод: чем больше дезэкранирован протон, тем в более слабое поле он резонирует.
Можно привести и другие примеры: если последовательно замещать протоны метана фенильными группами, то наблюдается закономерное изменение сигналов остающихся протонов.
| Соединение | CH4 | C6H5CH3 | (C6H5)2CH2 | (C6H5)3CH |
| Хим. сдвиг, δ | 0,23 | 2,34 | 3,92 | 4,63 |
Алифатический протон дифенилкарбониевого иона 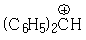 , имеющий сильно электроотрицательное окружение
, имеющий сильно электроотрицательное окружение 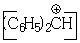 резонирует при 9,7 м.д. (δ). Химические сдвиги протонов СН3-группы, соединенной с насыщенным углеродным атомом (0,9 м.д.), азотом (2,2 м.д.) и кислородом (3,5 м.д.) также хорошо согласуется с относительными электроотрицательностями указанных атомов и групп.
резонирует при 9,7 м.д. (δ). Химические сдвиги протонов СН3-группы, соединенной с насыщенным углеродным атомом (0,9 м.д.), азотом (2,2 м.д.) и кислородом (3,5 м.д.) также хорошо согласуется с относительными электроотрицательностями указанных атомов и групп.
Если бы механизм экранирования включал в себя лишь диамагнитный эффект, то экранирование определялось бы только электроотрицательностями соседних атомов. И тогда, например, в ряду этан, этилен, ацетилен следовало бы ожидать закономерного убывания величины химического сдвига. Однако в спектрах этих соединений (в жидком состоянии) этан резонирует при 0,96 м.д., этилен - при 5,84 м.д. и ацетилен - при 2,88 м.д., соответственно. Т.е. имеется ещё какой-то вклад в магнитное экранирование.
Молекулярная составляющая σм.
Протоны органических молекул всегда испытывают в той или иной степени влияние парамагнитного экранирования. Парамагнитное экранирование является свойством электронных токов молекулы в целом, определенным образом ориентированных по отношению к внешнему магнитному полю. Если существует быстрое вращение вокруг связей, то молекулярное экранирование и дезэкранирование усредняются. В жестких молекулах это влияние существенно и может привести к экранированию или разэкранированию протона, в зависимости от его ориентации по отношению к индуцированным магнитным полям. Эффекты экранирования или дезэкранирование, зависящие от ориентации протона по отношению к индуцированным магнитным полям, называютсяанизотропными. Анизотропный эффект могут оказывать идиамагнитные токи соседней группы.
Ароматические кольца, тройная связь, атомы галогенов, карбонильная группа, двойная связь обладают значительной магнитной анизотропией.
Для двойной связи протоны испытывают анизотропное дезэкранирование (+)-экранирование, (-)-дезэкранирование.
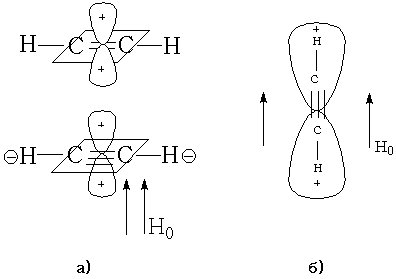
Для ацетилена в зависимости от расположения молекулы по отношению к направлению Н0 может быть как дезэкранирование –а), так и диамагнитное экранирование –б). Поэтому протоны при тройной связи резонируют в более сильном поле, чем при двойной.

Для ароматических протонов при расположении ароматического кольца перпендикулярно полю также наблюдается сильное анизотропное дезэкранирование. Для альдегидных протонов их местоположение (~ 9,5 м.д.) так же нельзя объяснить простым эффектом электроотрицательности карбонильной группы, в данном случае также наблюдается диамагнитный анизотропный эффект. Закономерности химических сдвигов углеродов в 13С аналогичны, но эффекты выражены сильнее.
Спин-спиновые взаимодействия.
При условии, что спин-решётчатая релаксация позволяет поддерживать больцмановское распределение, отношение интенсивностей полос поглощения, определяемое площадями пиков должно равняться отношению числа протонов, входящих в группу, резонирующих при данной частоте. Так в спектре низкого разрешения этанола имеются три полосы поглощения с соотношением площадей 1:2:3, отвечающие соответственно группам OH, CH2, CH3.
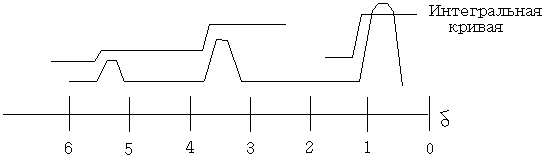
При более высоком разрешении сигналы, соответствующие CH2 и СН3 – группам расщепляются первый на четыре линии, а второй на три, причём расстояние между пиками метиленовой группы оказывается равным расстоянию между пиками метильной группы. Этот факт можно объяснить тем, что магнитное поле, взаимодействующее с протонами одной из групп, зависит от основного состояния протонов соседних групп.
а) у соседнего атома нет протонов, группа связанная с ним имеет вид синглета;
б) CН-группа возможно два варианта ориентации спина => соседние протоны будут иметь вид дублета равной интенсивности; 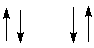
в) СН2-группа. Соседние группы будут иметь вид триплета с соотношением интенсивностей 1:2:1; 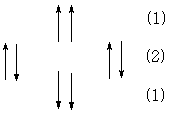
г) Для СН3-группы возможно четыре ориентации и соседняя группа будет иметь вид квартета с соотношением интенсивностей 1:3:3:1. 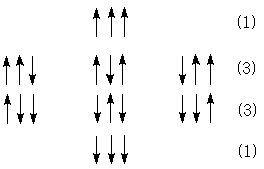
Расстояние между пиками мультиплета, образовавшегося в результате спин-спинового взаимодействия не зависит от напряженности внешнего магнитного поля. Расстояние между этими компонентами определяется эффективностью спин-спиновых взаимодействий и называется константой спин-спинового взаимодействия. Она обозначается символом J. Численно величину J определяют в Гц. Для большинства этильных групп J=6-8. Она резко убывает с ростом числа связей между ядрами. При передаче взаимодействия через 4 связи она равна ~ 1 Гц.
Вицинальные протоны. J изменяется в интервале 4-20 Гц. Мультиплетность какой-либо группы определяется для эквивалентных протонов как n+1.
СН3СН2СН3 => дублет (СН3) и секстет (СН2).
Компоненты мультиплетов расположены симметрично относительно центра, а их интенсивности пропорциональны коэффициентам членов ряда (τ+1)n. Для протонов, мало отличающихся, также можно использовать подобное простое соотношение:
грубо СН3СН2СН2Br
тр. секст. трипл. Это правило применимо тогда, когда Δν>>J (разделение пиков в ЯМР на порядок больше J).
Если протоны неэквивалентны, то при хорошем разрешении для СН2-средний => триплет от СН2 протонов расщепляется (каждая линия) на квартет от СН3 – протонов и суммарное количество линий в данном сигнале будет равно произведению числа соседних протонов.
Геминальные протоны. Константы спин-спинового взаимодействия между протонами, присоединенными к одному С-атому, могут меняться в широких пределах от 21,5 в циклопентендионе до 42,4 в формальдегиде.
Дата добавления: 2015-08-21; просмотров: 1132;
