Связь между удаленными протонами (дальняя связь).
В некоторых случаях в ЯМР-спектрах наблюдается расщепление сигналов протонов вследствие спин-спиновой связи с другими протонами, разделенными четырьмя, пятью и более связями. Дальняя спин-спиновая связь чаще проявляется в структурах, содержащих кратные связи, особенно алленовые и ацетиленовые. Хотя такие взаимодействия обнаружены и в насыщенных системах с гетероатомами.
Анализ сложных ЯМР-спектров.
Согласно приведенным выше простым правилам мультиплетности площади компонентов мультиплета должны относится между собой как простые целые числа. Например, соотношение пиков в квартете должно составлять 1:3:3:1. Фактически всегда наблюдается более сложная картина. Даже если сигналы отделены друг от друга на расстояние в 150 Гц (как для СН2СН3 – группы) площади компонентов мультиплетов не кратны друг другу: например для СН2 протонов => 0,9 : 2,9 : 3,1 : 1,1, а для метильных => 1,1 : 2,0: 0,9. Известно, что интенсивность спин-спинового мультиплета выше в том направлении спектра, где расположены сигналы от протонов, ответственных за наблюдаемое расщепление.
Если расстояние между сигналами двух взаимодействующих протонов составляет величину примерно одного порядка с константой их спин-спинового расщепления, то необходим более сложный анализ. При этом ядра, имеющие близкие хим. сдвиги обозначают А, В,…, а ядра с хим. сдвигами отличными от них – х,у …
Расчёт АВ системы 1) Если А=В, то в спектре присутствует один сигнал.
2) Если А и В сильно отличаются, что в спектре присутствуют два дублета с одинаковой константой.
3) Если А и В отличаются незначительно, то спектр состоит из четырёх линий, внешне линии менее интенсивны, чем внутренние. С увеличением JАВ / ΔνАВ интенсивность внутренних пиков растёт, а внешних падает.
JАВ= |1-2|=|3-4|
νАВ= (ν1,32- JАВ2)1/2=[( ν2,3+ JАВ)2- JАВ]1/2
Графический анализ.
Наносятся 4 вертикальные линии, соответствующие поглощению четырёх линий спектра, и пересекающую их горизонтальную линию. Из точки пересечения ν, с горизонтальной линией проводят радиусом ν1,3 дугу до пересечения с линией ν2. Расстояние от этой точки до горизонтальной линии → это νАВ. От центра спектра вправо и влево откладывают ½ νАВ. Левая точка νА, а правая → νВ.
 Система АВХ. Можно рассчитать графически. Для этого в области АВ выбирают два квартета, как это показано на рисунке. Один обозначают (АВ)′ и второй (АВ)″. Графический анализ, как показано на рисунке, позволяет найти JАВ, JВХ, νА, νВ и νХνВ= νВ′-1/2 JВХ νА= νА′-1/2 JАХ
Система АВХ. Можно рассчитать графически. Для этого в области АВ выбирают два квартета, как это показано на рисунке. Один обозначают (АВ)′ и второй (АВ)″. Графический анализ, как показано на рисунке, позволяет найти JАВ, JВХ, νА, νВ и νХνВ= νВ′-1/2 JВХ νА= νА′-1/2 JАХ

Спектр а) приведен при одинаковых знаках констант JАХ и JВХ и
б) при разных
Структурные корреляции.
Частота протонного магнитного резонанса может быть измерена по отношению к внутреннему стандарту с точностью до + 0,02 м.д. В таблице 3.1 приведены примерные химические сдвиги протонов различных типов органических соединений. При этом имеется ввиду, что функциональные группы соединены с насыщенными углеродными атомами.
Алифатические протоны как правило являются более экранированными по сравнению с протонами других типов органических соединений, если они не испытывают разэкранирующего влияния соседних атомов или групп. Метильные группы с насыщенным углеродным окружением дают ЯМР-сигнал около 0,9 м.д. Ациклические метиленовые протоны резонируют около 1,25 м.д., ещё менее экранированы метиновые протоны- 1,5 м.д.
Экранирование протона в циклических соединениях зависит от размера цикла:
| Число звеньев | ||||||
| Хим. сдвиги (δ) | 0,22 | 1,97 | 0,51 | 1,43 | 1,53 | 1,53 |
Большинство метильных групп, соединённых с карбонильной группой даёт чёткий синглет с интенсивностью, соответствующей трем протонам, в области 1,9-2,2 м.д. Например:
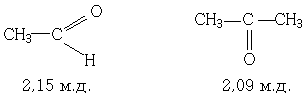
Исключением являются метильные группы в арилметилкетонах. Они резонируют при 2,6 м.д. Как и следовало ожидать несколько менее экранированы метиленовые и метиновые группы (~ 2,4 м.д.). Различия в частотах ЯМР-сигналов алкильных групп, соединённых с альдегидными, кетонными, карбоксильными, сложноэфирными и амидными, карбонильными группами, недостаточны для того, чтобы различать перечисленными группы по их ЯМР-спектрам.
Метильные группы, соединённые с изолированными двойными связями дают сигнал в области 1.6-1.8 δ. Для СН3-группы, находящейся у сопряженной системы, сигнал сдвигается до 1.8-2.1 м.д. (δ).
Метильные группы, соединенные с ароматическими ядрами, дают сигнал около 2,3 м.д. и лишь сильно нуклеофильные или электрофильные заместители могут повлиять на местоположение этого сигнала.
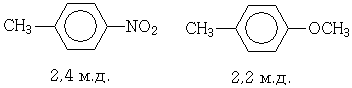
Протоны- ОСН3 группы обычно дают сигналы при 3,3-4,0 м.д. N-СН3 – при 2,1-3,0, SСН3 - 2,1-2,8. При этом сигнал S-СН синглет (узкий и хорошо разрешённый), а 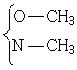 может иметь вид мультиплета (взаимодействие через азот или кислород с другими протонами).
может иметь вид мультиплета (взаимодействие через азот или кислород с другими протонами).
Спиртовая ОСН2 резонирует ~ 3,6 м.д., а сложноэфирная ОСН2 - 4,1м.д. Для вторичных спиртов ОСН наблюдается при 3,9 м.д., а для сложных эфиров со вторичным спиртом при 5,0 м.д.
Олефиновые протоныдают сигнал при 4,6-6,4 м.д. Если имеется сопряжение двойной связи с какой-либо ненасыщенной группой, то ЯМР – сигнал олефиновых протонов в некоторых случаях сдвигается в более слабое поле, вплоть до 8,0 м.д. за счет парамагнитного разэкранирующего эффекта.
Ацетиленовые протоны дают сигнал при 2,5 м.д.
Альдегидные протоныдают сигнал в области 9,4-10,0 м.д. Для алифатических альдегидов 9,4-9,6 м.д. Ароматические резонируют при 10-10,2 м.д.
Таблица VI.10. Аддитивные параметры экранирования олефинов, в м.д. [115]
| Заместитель R | 2R | ||
| гем | цис | транс | |
| H | 0,0 | 0,0 | 0,0 |
| Alk | 0,45 | -0,22 | -0,28 |
| Alk(цикл.)* | 0,69 | -0,25 | -0,28 |
| СH2Ar | 1,05 | -0,29 | -0,32 |
| CH2X (X=F,Cl,Br) | 0,70 | 0,11 | -0,04 |
| CH2I | 0,670 | -0,02 | -0,07 |
| CF3 | 0,66 | 0,61 | 0,32 |
| CH2OH | 0,64 | -0,01 | -0,02 |
| CH2C(O); CH2CN | 0,69 | -0,08 | -0,06 |
| CH2SH | 0,71 | -0,13 | -0,22 |
| CH2NH2 | 0,58 | -0,10 | -0,08 |
| C═C (изолир.) | 1,00 | -0,09 | -0,23 |
| C═C (сопряж.)** | 1,24 | 0,02 | -0,05 |
| Ar | 1,38 | 0,36 | -0,07 |
| Ar (o-зам.) | 1,65 | 0,19 | 0,09 |
| C≡C | 0,47 | 0,38 | 0,12 |
| F | 1,54 | -0,40 | -1,02 |
| Cl | 1,08 | 0,18 | 0,13 |
| Br | 1,07 | 0,45 | 0,55 |
| I | 1,14 | 0,81 | 0,88 |
| OR (R алифат.) | 1,22 | -1,07 | -1,21 |
| OR (R сопряж.) | 1,21 | -0,60 | -1,00 |
| OC(O)R | 2,11 | -0,35 | -0,64 |
| NR (R алифат.) | 0,80 | -1,26 | -1,21 |
| NR (R сопряж.) | 1,17 | -0,53 | -0,99 |
| С═O (изолир.) | 1,10 | 1,12 | 0,87 |
| С═O (сопряж.) | 1,06 | 0,91 | 0,74 |
| C(O)H | 1,02 | 0,95 | 1,17 |
| COOH (изолир.) | 0,97 | 1,41 | 0,71 |
| COOH (сопряж.) | 0,80 | 0,98 | 0,32 |
| COOR (изолир.) | 0,80 | 1,18 | 0,55 |
| COOR (сопряж.) | 0,78 | 1,01 | 0,46 |
| C(O)N | 1,37 | 0,98 | 0,46 |
| C(O)Cl | 1,11 | 1,46 | 1,01 |
| N•C(O) | 2,08 | -0,57 | -0,72 |
| C≡N | 0,27 | 0,75 | 0,55 |
| SR | 1,11 | -0,29 | -0,13 |
| SO2 | 1,55 | 1,16 | 0,93 |
*Двойная связь и заместитель входят в цикл (за исключением 3- и 4-х членных).
**Инкременты R (сопряж.) используют тогда, когда либо заместитель, либо двойная связь сопряжены с другими фрагментами.
На основании изучения ЯМР-спектров 1Н более тысячи олефинов Паскаль с соавторами предложил уравнение, позволяющее с довольно высокой точностью (± 0,3 м.д.) вычислить химические сдвиги олефиновых протонов по уравнению:
δ C═C─H = 5,25+Zгем+ Zцис+ Zтранс
где 5,25-хим. сдвиг (м.д.) протонов этилена,
Zi–аддитивные параметры экранирования соответствующими заместителями.
Ароматические протоны замещённых бензолов обычно дают сигналы в интервале 7,5-8,0 м.д. При этом электроакцепторные группы смещают положение пика в область слабого поля, а электронодонорные - в область сильного поля, что объясняется локальным диамагнитным экранированием. Предельные значения химических сдвигов ароматических протонов наблюдаются у 1,3,5- тринитробензола (9,5 м.д.) и 1,3,5-триметоксибензола (5,95). На величины химических сдвигов ароматических протонов орто-заместители оказывают наибольшее, а мета-заместители наименьшее влияние. Например.
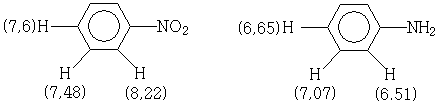
Местоположение сигнала ароматического протона можно рассчитать по уравнению
n
δНi =7,26 ±∑ Ai (Ri)
i=1
, где
7,26 - местоположение сигнала водородных атомов незамещённого бензола
Аi - инкримент i-го заместителя (поправочный коэффициент, учитывающий влияние данного заместителя на местоположение сигнала в спектре ПМР).
Таблица VI.19 Инкременты заместителей для расчета химических сдвигов ароматических протонов монозамещенных бензолов в разбавленных растворах. ССI4 [125]
| Заместитель | δ. м.д. (относительно бензола) | Заместитель | δ. м.д. (относительно бензола) | ||||
| орто | мета | пара | орто | мета | пара | ||
| Н | C(O)CMe3 | 0,44 | 0,05 | 0,05 | |||
| Ме | -0,20 | -0,12 | -0,22 | COPh | 0,47 | 0,13 | 0,22 |
| Еt | -0,14 | -0,06 | -0,17 | COOH | 0,85 | 0,18 | 0,27 |
| i-Pr | -0,13 | -0,08 | -0,18 | COOMe | 0,71 | 0,11 | 0,21 |
| i-Bu | 0,02 | -0,08 | -0,21 | COOPr-i | 0,70 | 0,09 | 0,19 |
| CF3 | 0,32 | 0,14 | 0,20 | COOPh | 0,90 | 0,17 | 0,27 |
| CH2Cl | CONH2 | 0,61 | 0,10 | 0,17 | |||
| CCl3 | 0,64 | 0,13 | 0,10 | COCl | 0,84 | 0,22 | 0,36 |
| CH2OH | -0,07 | -0,07 | -0,07 | COBr | 0,80 | 0,21 | 0,37 |
| CH=CH2 | 0,06 | -0,03 | -0,10 | CN | 0,36 | 0,18 | 0,28 |
| CH=CH-Ph | 0,15 | -0,01 | -0,16 | NH2 | -0,73 | -0,25 | -0,67 |
| C≡CH | 0,15 | -0,02 | -0,01 | NHMe | -0,80 | -0,22 | -0,68 |
| C≡C−Ph | 0,19 | 0,02 | 0,00 | NMe2 | -0,66 | -0,18 | -0,67 |
| Ph | 0,37 | 0,20 | 0,10 | NHCOMe | 0,12 | -0,07 | -0,28 |
| F | -0,26 | 0,00 | -0,20 | NMeCOMe | -0,16 | 0,05 | -0,02 |
| Cl | 0,03 | -0,02 | -0,09 | [NMe3]+I– | 0,69 | 0,36 | 0,31 |
| Br | 0,18 | -0,08 | -0,04 | NH–NH2 | -0,60 | -0,08 | -0,55 |
| I | 0,39 | -0,21 | 0,00 | N=N–Ph | 0,67 | 0,20 | 0,20 |
| OH | -0,58 | -0,14 | -0,47 | NO2 | 0,95 | 0,26 | 0,38 |
| OMe | -0,48 | -0,09 | -0,44 | NO | 0,58 | 0,31 | 0,37 |
| OEt | -0,46 | -0,10 | -0,43 | SH | -0,08 | -0,16 | -0,22 |
| OPh | -0,29 | -0,05 | -0,23 | SMe | -0,08 | -0,10 | -0,24 |
| OC(O)Me | -0,27 | 0,00 | -0,14 | SPh | 0,06 | -0,09 | -0,15 |
| OC(O)Ph | -0,09 | 0,09 | -0,08 | SO3Me | 0,60 | 0,26 | 0,33 |
| OSO2Me | -0,05 | 0,07 | -0,01 | SO2Cl | 0,76 | 0,35 | 0,45 |
| CHO | 0,56 | 0,22 | 0,29 | PO(OMe)2 | 0,48 | 0,16 | 0,24 |
| C(O)Me | 0,62 | 0,14 | 0,21 | SiMe3 | 0,22 | -0,02 | -0,02 |
Для гетероциклических соединений протоны, расположенные в α-положении к гетероатому дают ЯМР-сигнал в более слабом низком поле, чем протоны в других положениях
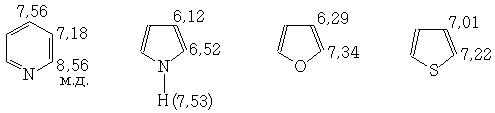
Водород, связанный с неуглеродными атомами.
Спирты. Гидроксильный водород при обычных условиях (10-90 моль % в инертном растворителе) дает сигнал ЯМР около 4-5,5 м.д. При сильном разбавлении положение ЯМР-сигнала гидроксильного протона смещается к более высоким полям (в парах при 220 оС δ = 0,71 м.д.). Сдвиг в сторону сильного поля наблюдается и при увеличении температуры, при которой снимается спектр.
Фенолы. Протоны ОН-группы фенолов при обычных концентрациях дают сигналы около 6,0-7,7 м.д. Также как и для спиртов положение сигнала зависит от концентрации и температуры.
| С, % 100 20 10 5 2 1 |
| δ, м.д. 7,75 6,75 6,45 5,95 4,88 4,37 |
Изменение концентрации не влияет на местоположение сигналов ОН-группы фенолов, способных образовывать внутримолекулярную водородную связь. Например:
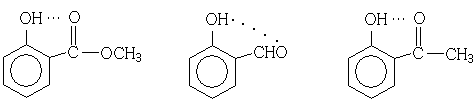
δ(H) = 10,58 δ(H) = 10,95 δ(H) = 12,05
Енолы.
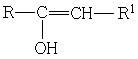 Протон гидроксильной группы наблюдается в очень сильных полях ~ 16 м.д. и местоположение его обычно не зависит от разбавления.
Протон гидроксильной группы наблюдается в очень сильных полях ~ 16 м.д. и местоположение его обычно не зависит от разбавления.
Карбоновые кислоты дают сигнал от ОН-протона в области 10,5-12 м.д. Он не смещается заметно при разбавлении раствора инертными растворителями, т.к. кислоты образуют димеры.
Амины. Аминные протоны обычно дают в спектре узкие синглеты, что как и в случае спиртов, указывает на быстрый химический обмен этими протонами. Аминные протоны алифатических аминов дают пики при 0,3-2,2 м.д., а ароматических при –2,6-4,7 м.д. Эти пики смещаются при разбавлении в более сильное поле. Теоретически, поскольку спин ядра атома азота равен 1, то сигнал протона, соединенного с ним должен представлять триплет. В действительности же, только в кислых растворах протоны рядом с аминогруппой имеют характер триплета, в нейтральных и щелочных растворах происходит быстрый обмен между NH- или ОН- и NH2-группами и за счёт этого сигналы усредняются, и имеют вид уширенного синглета.
Амиды. Н–N – в амидах дают уширенные сигналы в области – 5-8,5 м.д. Амидные протоны не участвуют в быстром химическом обмене и поэтому имеет место расщепление протонов у соседних с ними алкильных групп.
Тиолы. S–H – поглощение проявляется при 2,2-2,6 м.д., для ароматических S–H – при 3,6 м.д.
Спектры ЯМР 13 С.
Наличие в природном углероде 1,108 % изотопа 13С, обладающего магнитным моментом и спином ½ позволяет получать спектр ЯМР на его ядрах. Значения констант взаимодействия 13С и 1Н, непосредственно связанного с данным углеродным атомом велики и зависят от типа гибридизации данного углеродного атома. С увеличением S-характера величина Jн-с увеличивается.
Например:
| Соединение | Состояние гибридизации | S-характер | J, Гц |
| метан | SP3 | ||
| бензол | SP2 | 33,3 | |
| метилацетилен | SP |
Обычно спектры ЯМР 13С укладываются в интервал 400 Гц. Химические сдвиги углеродных атомов в спектре ЯМР 13С достаточно характеристичны, что видно из следующей таблицы.
| Углеродсодержащие группы | δ 13С, м.д. | Углеродсодержащие группы | δ 13С, м.д. |
| Si(CH3) | C═N насыщенные соединения ненасыщенные соединения | 145-165 110-120 | |

| –5-55 | C═O альдегиды и кетоны кислоты, сложные эфиры, амиды, галогенангидриды ангидриды | 175-225 155-185 150-165 |
| ═C─олефины | 100-150 | C═S тионы | 220-235 |
| ═C─ароматические соединения | 110-150 | C≡N | 110-125 |
| ≡С─ | 65-90 | 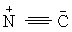
| 150-160 |
| 1 2 3 C═C═C | 1 2 70-95 (С С) 200-215 (С) | 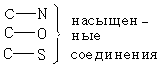
| 30-70 40-85 10-70 |
ЯМР 13С – уникальный метод для изучения структуры органических молекул. Спектры ЯМР 13С снятые с подавлением спин-спинового взаимодействия с протонами высоко характеристичны: каждому С-атому, как правило, соответствует свой сигнал, причём набор сигналов характерен именно для этого соединения.
Чувствительность химических сдвигов сигналов 13С к структурным изменениям примерно на порядок превышает таковую в ЯМР- спектроскопии 1Н.
Характерная особенность ЯМР- спектроскопии 13С – аддитивность влияния заместителей.
R m
δС = C + ∑ niRAi
i=1
C – химический сдвиг эталона
ni – число заместителей в i- положении
Ai – инкримент химического сдвига i-го заместителя.
В таблицах 4. и 5. приведены химические сдвиги и инкрименты заместителей для нормальных и изоалканов.
Таблица 4. Химические сдвиги 13С алканов [98]
| Соединение (углеродная цепь) | Атом углерода | ||||||
| CH4 | -2,3 | - | - | - | - | - | - |
| C2H6 | 5,7 | - | - | - | - | - | - |
| C3H8 | 15,4 | 15,9 | - | - | - | - | - |
| C4H10 | 13,1 | 24,9 | - | - | - | - | - |
C5H12
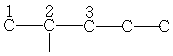
| 13,5 | 22,2 | 34,1 | - | - | - | - |
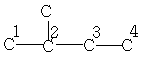
| 21,9 | 29,9 | 31,6 | 11,5 | - | - | - |
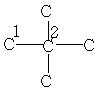
| 31,6 | 28,0 | - | - | - | - | - |

| 22,7 | 25,7 | 49,0 | - | - | - | - |
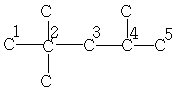
| 29,5 | 30,6 | 47,3 | 18,1 | 15,1 | - | - |
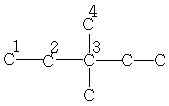
| 7,7 | 33,4 | 32,3 | 25,6 | - | - | - |
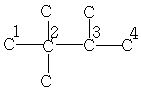
| 27,0 | 32,7 | 37,9 | 17,7 | - | - | - |
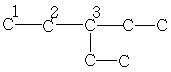
| 10,5 | 25,2 | 42,4 | - | - | - | - |
C6H14
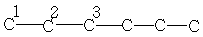
| 13,7 | 22,7 | 31,7 | - | - | - | - |
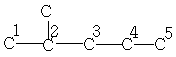
| 22,7 | 27,9 | 11,9 | 20,8 | 14,3 | - | - |
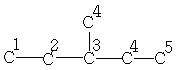
| 11,4 | 29,4 | 36,8 | 18,7 | - | - | - |

| 28,7 | 30,3 | 36,5 | 8,5 | - | - | - |
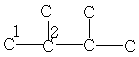
| 19,2 | 34,0 | - | - | - | - | - |
C7H16
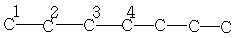
| 13,7 | 22,6 | 32,0 | 29,0 | - | - | - |
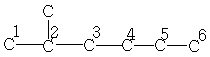
| 22,4 | 28,1 | 38,9 | 29,7 | 23,0 | 13,6 | - |
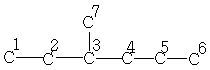
| 10,9 | 29,5 | 34,3 | 39,0 | 20,2 | 13,9 | 18,8 |
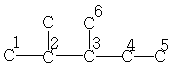
| 20,0* | - | - | - | - | - | - |
| 17,7 | 31,9 | 40,6 | 26,8 | 11,6 | 14,5 | - |
*Удвоение сигналов обусловлено магнитной неэквивалентностью С-атомов.
Таблица 5. Влияние заместителей на химические сдвиги 13С(Δδ, м.д.) линейных (н-) и разветвленных (изо) алканов при замещении Н на Х.
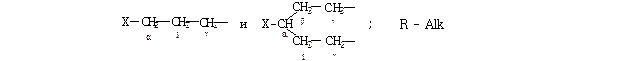
| Х | α | β | γ | ||
| н- | изо- | н- | изо- | ||
| СН3 | -2 | ||||
| CH═CH2 | - | - | -3,5 | ||
| C≡CH | 4,5 | - | 5,5 | - | -3,5 |
| Ph | -2 | ||||
| F | -7 | ||||
| Cl | -5 | ||||
| Br | -4 | ||||
| I | -7 | -2 | |||
| OH | -6 | ||||
| OR | -4 | ||||
| OC(O)CH3 | 6,5 | -4 | |||
| C(O)H | - | - | -2 | ||
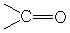
| - | - | |||
| C(O)CH3 | -3,5 | ||||
| C(O)OH | -3 | ||||
| COO- | 3,5 | -2 | |||
| C(O)OCH3(и C2H5) | 22,5 | -3 | |||
| C(O)Cl | -3,5 | ||||
| C(O)NH2 | - | 2,5 | - | -3 | |
| C═N–OH | |||||
| син | 11,5 | - | 0,5 | - | -2 |
| анти | - | 4,5 | - | -1,5 | |
| NH2 | 28,5 | 11,5 | -5 | ||
| NH3+ | -5 | ||||
| NHR | -4 | ||||
| NR2 | 40,5 | - | - | -4,5 | |
| NR3+ | 30,5 | - | 5,5 | - | -7 |
| NO2 | 61,5 | -4,5 | |||
| –C≡N | -3 | ||||

| 27,5 | - | 6,5 | - | -4,5 |
| SH | 10,5 | 11,5 | -3,5 | ||
| –S– | -3,5 | ||||
| SCH3 | -3 | ||||
| S(CH3)2+ | -3 | ||||
| S(O)CH3 | -3 | ||||
| SO2CH3 | -3 |
Спектроскопия ЯМР. Лекция 4.
Химические сдвиги 13С олефинов расположены в интервале 100-150 м.д. и отличаются высокой характеристичностью. Причём химические сдвиги концевых метиленовых групп (–СН2), как правило, расположены в более высоких полях (на 10-40 м.д.), чем хим. сдвиги атомов, связанных с алкильными заместителями. В таблицах 4. и 4 приведены примерные химические сдвиги накоторых олефиновых углеродов.
Таблица 4.
Химические сдвиги 13С 1-замещенных этиленов ХС(1)Н+С(2)Н2
| Заместитель Х | δC1 | δC2 | Заместитель Х | δC1 | δC2 |
| H | 123,3 | 123,3 | Br | 116,1 | 122,6 |
| Me | 133,6 | 115,5 | I | 85,9 | 131,0 |
| Et | 139,0 | 112,1 | OCH3 | 153,6 | 86,0 |
| Pr | 137,3 | 113,1 | OCOCH3 | 141,6 | 96,3 |
| t-Bu | 148,1 | 108,1 | CHO | 136,9 | 136,5 |
| CH2=CH | 136,9 | 116,3 | COOH | 128,5 | 132,4 |
| Ph | 136,7 | 113,2 | COOC2H5 | 129,7 | 130,4 |
| F | 148,2 | 89,0 | CN | 108,2 | 138,3 |
| Cl | 126,6 | 117,9 |
Таблица 4.
Интервалы и средние значения химических сдвигов 13С олефинов [104] *
| Фрагмент | Среднее значение | Интервал | Число экспери-ментальных точек |
| * CH3–CH=C | 123,4(0,9) | 116,0-143,7 | |
| * CH3–CH=C | 135,7(0,8) | 129,5-148,1 | |
| * CH3–CH=CH–C | 124,6(0,9) | 119,3-143,7 | |
| * CH3–CH=CH–C | 133,5(0,8) | 129,5-143,7 | |
| * CH3–CH=CH–CH2–C | 123,9(0,2) | 122,0-125,8 | |
| * CH3–CH=CH–CH2–C | 131,0(0,2) | 129,5-133,2 | |
| * CH2=CH–CH2–C | 116,6(1,5) | 112.0-127,2 | |
| * CH2=CH–CH2–C | 135,9(1,3) | 128,0-139,1 | |
| * * C–CH2–CH=CH–CH2–C | 130,4(0.3) | 123,3-135,4 | |
| * CH3–C(CH3)=CH–C | 130,3(0.5) | 124,5-132,4 | |
| * CH3–C(CH3)=CHC | 128,0(2.0) | 123,1-135,5 | |
| * C=CH–COOH | 153,5(0.9) | 147,6-158,3 | |
| * C=CH–CO–O–C | 136,1(3.3) | 129,4-147,5 |
* См. примечание к табл. VI.5.
Химические сдвиги 13С линейных и разветвленных ацетиленовых углеводородов можно оценить по уравнению:
n
δ≡C =71,9 +∑ Aкi (Ri)
i=1
где 71,9- химический сдвиг ацетилена (м.д.)
Aкi (Ri)- инкрименты атомов углерода в соот. положении.
Таблица 4.
Инкрименты для оценки химических сдвигов ацетиленовых углеводородов
| Ri | Aki (Ri), м.д. | ||||||||
| -Сδ΄- | -Сγ΄- | -Сβ΄- | С-Сα΄ | ≡C | -Сα- | -Сβ- | -Сγ- | -Сδ- | |
| С | 0,56 | -1,31 | 2,32 | -5,69 | 6,93 | 4,75 | -0,13 | 0,51 |
Таблица 4.
Инкрименты для оценки химических сдвигов 13С дизамещённых ацетиленов R΄C ≡ CR΄΄
δ≡C = 41,2 + X1+ X2
| Замести- тель | X1 | X2 | Число соединений, содержащих заместитель | Замести- тель | X1 | X2 | Число соединений, содержащих заместитель |
| H | -18,9 | 49,4 | -1,4 | 72,5 | |||
| Me | -11,2 | 45,0 | -3,4 | 73,2 | |||
| Et | -5,5 | 45,3 | -1,4 | 70,8 | |||
| Bu | -5,9 | 46,1 | -4,4 | 72,6 | |||
| t-Bu | 1,6 | 43,8 | -3,3 | 76,2 | |||
| Ph | -6,9 | 55,4 | -4,7 | 76,2 | |||
| n-MeOC6H4 | -7,0 | 54,3 | -17,3 | 66,4 | |||
| n-MeC6H4 | -7,1 | 54,9 | -34,9 | 52,6 | |||
| n-CLC6H4 | -8,3 | 56,4 | -8,1 | 56,1 | |||
| CH2=CH | -9,0 | 56,1 | -2,8 | -2,9 | |||
| HC≡C | -22,2 | 42,2 | -18,4 | 60,6 | |||
| C(Me)2OH | -1,5 | 49,6 | -10,0 | 58,7 |
Химические сдвиги 13С замещенных бензолов расположены в области 100-165 м.д. Их также можно оценить с помощью седдитивного уравнения:
n
δCR =129,0 +∑ Ai (Ri)
i=1
Аддитивные константы приведены в следующей таблице:
Таблица 4.
Инкременты заместителей для расчёта химических сдвигов 13С монозамещенных бензолов в растворах ССl4 и/или СDCl3 (кроме особо указанных случаев) [128]
| X | Δδ, м.д. | |||
| C1 | орто | мета | пара | |
| H | ||||
| Me | 9,22 | 0,66 | -0,11 | -3,04 |
| Et | 15,59 | -0,48 | 0,0 | -2,65 |
| Pr | 14,3 | -,01 | 0,1 | -2,7 |
| i-Pr | 22,38 | -3,32 | -0,40 | -3,06 |
| t-Bu | 22,3 | -3,5 | -0,5 | -3,2 |
| t-Bu+(SO2ClF) | 11,5 | 13,9 | 4,8 | 27,4 |
| CF3 | -9,0 | -2,2 | 0,3 | 3,2 |
| CH2F | 8,1 | -0,9 | 0,1 | 0,2 |
| CH2Cl | 9,4 | 0,3 | 0,4 | 0,2 |
| CH2Br | 9,7 | 1,0 | 1,3 | 0,6 |
| CH2OH | 13,3 | -0,8 | 0,6 | -0,4 |
| CH2OCH2C6H5 | 10,5 | -0,5 | 0,5 | -0,5 |
| CH2NH2 | 15,5 | -1,1 | 0,0 | -1,9 |
| CH2NHCH2C6H5 | 11,9 | -0,5 | -0,3 | -1,7 |
| CH2SCH2C6H5 | 10,5 | 0,3 | 0,9 | -1,5 |
| (циклопропил) | 15,1 | -3,3 | -0,6 | -3,6 |
| СH=CH2 | 8,9 | -2,3 | -0,1 | -0,8 |
| CH=CHMe | 9,5 | -2,5 | 0,0 | -1,9 |
| C(Me)=CH2 | 12,6 | -3,1 | -0,4 | -1,2 |
| C≡CH | -6,2 | 3,6 | -0,4 | -0,3 |
| C≡C–Me | -4,4 | 3,0 | -0,3 | -1,0 |
| F | 34,75 | -12,97 | 1,58 | -4,41 |
| Cl | 6,3 | 0,4 | 1,4 | -1,9 |
| Br | -5,8 | 3,2 | 1,6 | -1,6 |
| I | -34,1 | 8,9 | 1,6 | -1,1 |
| OH | 26,90 | -12,80 | 1,35 | -7,40 |
| ONa(EtOH) | 39,6 | -8,2 | 1,9 | -13,6 |
| OMe | 31,40 | -14,42 | 1,04 | -7,71 |
| OCH=CH2 | 28,2 | -11,5 | 0,7 | -5,8 |
| OPh | 27,6 | -11,2 | -0,3 | -6,9 |
| OC(O)Me | 22,4 | -7,1 | 0,4 | -3,2 |
| CHO | 8,4 | 1,2 | 0,5 | 5,7 |
| COMe | 8,9 | 0,1 | -0,1 | 4,4 |
| COCF3 | -5,6 | 1,8 | 0,7 | 6,7 |
| COCH=CHPh | 9,7 | 1,9 | 1,9 | 4,1 |
| COPh | 9,3 | 1,6 | -0,3 | 3,7 |
| COC≡CH | 7,4 | 1,0 | 0,0 | 5,9 |
| COOH | 2,1 | 1,6 | -0,1 | 5,2 |
| COONa(H2O) | 8,4 | 0,5 | -0,5 | 2,2 |
| COOMe | 2,0 | 1,2 | -0,1 | 4,3 |
| COOEt | 2,1 | 1,0 | -0,5 | 3,9 |
| COF | 4,3 | 1,6 | -0,7 | 5,3 |
| COCl | 4,7 | 2,7 | 0,3 | 6,6 |
| CONH2 | 5,0 | -1,2 | 0,1 | 3,4 |
| CONMe2 | 8,0 | -1,5 | -0,2 | 1,0 |
| H2N | 18,2 | -13,4 | 0,8 | -10,0 |
| + NH3(CF3COOH) | 0,1 | -5,8 | 2,2 | 2,2 |
| NHMe | 21,4 | -16,2 | 0,8 | -11,6 |
| NMe2 | 22,5 | -15,4 | 0,9 | -11,5 |
| + NMe3(ДМСО) | 19,5 | -7,3 | 2,5 | 2,4 |
| NHEt | 20,0 | -15,7 | 0,7 | -11,4 |
| NEt2 | 19,3 | -16,5 | 0,6 | -13,0 |
| NHPh | 14,7 | -10,6 | 0,9 | -10,5 |
| NHPh2 | 19,8 | -7,0 | 0,9 | -5,6 |
| NHCOCH3 | 9,7 | -8,1 | 0,2 | -4,4 |
| NH–NH2 | 22,8 | -16,5 | 0,5 | -9,6 |
| NO2 | 19,9 | -4,9 | 0,9 | 6,1 |
| N=CHC6H5 | 24,5 | -6,9 | 1,0 | -1,9 |
| N=C=NC6H5 | 10,8 | -3,6 | 1,7 | -2,2 |
| N=C=O | 5,1 | -3,7 | 1,1 | -2,8 |
| N=C=S | 3,0 | -2,7 | 1,3 | -1,0 |
| C≡N | -15,7 | 3,6 | 0,7 | 4,3 |
| + - N≡C | -1,8 | -2,2 | 1,4 | 0,9 |
| N=N–C6H5 | 24,2 | -5,5 | 1,2 | 3,3 |
| + - N≡N(SO2) | -12,7 | 6,0 | 5,7 | 16,0 |
| SH | 2,1 | 0,7 | 0,3 | -3,2 |
| SMe | 10,0 | -1,9 | 0,2 | -3,6 |
| SC6H5 | 7,3 | 2,4 | 0,6 | -1,6 |
| + SMe2(ДМСО) | -1,0 | 3,1 | 2,2 | 6,3 |
| SSPh(ДМСО) | 7,5 | -1,3 | 0,8 | -1,1 |
| SCN (чистая жидкость) | -3,7 | 2,5 | 2,2 | 2,2 |
| SOMe | 17,6 | -5,0 | 1,1 | 2,4 |
| SO2Me | 12,3 | -1,4 | 0,8 | 5,1 |
| SO2OH(H2O) | 14,5 | -2,7 | 0,8 | 3,3 |
| SO2Cl | 15,6 | -1,7 | 1,2 | 6,8 |
| PMe2 | 13,6 | 1,6 | -0,6 | -1,0 |
| P(Ph)2 | 9,3 | 5,5 | 0,3 | 0,0 |
| SiMe3 | 11,6 | 4,9 | -0,7 | 0,4 |
| GeMe3 | 13,7 | 4,5 | -0,5 | -,02 |
| SnMe3 | 13,4 | 7,4 | -0,2 | -0,3 |
| PbMe3 | 20,1 | 8,0 | -0,1 | -1,0 |
| HgPh(Me2CO) | 39,1 | 9,5 | -0,3 | -0,8 |
Двойной ядерный магнитный резонанс.
Протоны метиленовой группы подкисленного этилового спирта дают квартет (рис 4), т.к. они испытывают ориентирующее влияние протонов метильной группы. Вместе с тем, эти протоны не участвуют в спиновом взаимодействии с протонами гидроксильной группы из-за быстрого химического обмена с ними. Если бы протоны метильной группы с такой же высокой скоростью могли претерпевать химический обмен, то сигнал от метиленовой группы имел бы вид синглета. Этого можно достичь, применяя очень сильное стационарное радиочастотное поле с частотой, близкой к резонансной частоте протонов метильной группы. При этом происходит насыщение протонов метильной группы. По этому метиленовая группа имеет вид синглета. А так как при этом используется дополнительное поле, этот метод называют методом двойного резонанса.
В результате применения метода ДЯМР применительно к этиловому спирту при насыщении протонов метильной группы сигнал метиленовых протонов выраждается в дублет, т.к. метиленовые протоны взаимодействуют лишь с гидроксильным протоном. Аналогично, при насыщении протонов метиленовой группы сигналы гидроксильной и метильной групп превращаются в синглеты.
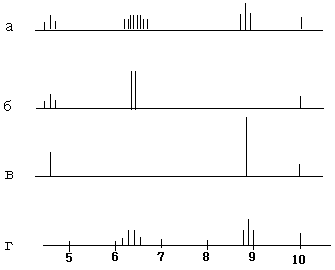 τ
τ
а) обычный ЯМР-спектр
б) ЯЯМР (двойной резонанс) при насыщении метильной группы.
в) ЯЯМР при насыщении метиленовой группы.
г) ЯЯМР при насыщении гидроксильной группы.
Важнейшей областью применения двойного ядерного магнитного резонанса является интерпретация сложных ЯМР-спектров. Подавление по протонам какой-либо группы позволяет получить более простой спектр.
Метод тройного резонанса, хотя и не нашедший ещё широкого применения может быть также использован для интерпретации спектров. В этом случае на выбранные участки спектра накладывают два дополнительных стабильных радиочастотных поля. Однако, обычно достаточно ЯЯМР.
Дата добавления: 2015-08-21; просмотров: 1382;
